Bihar Board Class 11 Chemistry Solutions Chapter 11 p-ब्लॉक तत्त्व Textbook Questions and Answers, Additional Important Questions, Notes.
BSEB Bihar Board Class 11 Chemistry Solutions Chapter 11 p-ब्लॉक तत्त्व
Bihar Board Class 11 Chemistry p-ब्लॉक तत्त्व Text Book Questions and Answers
अभ्यास के प्रश्न एवं उनके उत्तर
प्रश्न 11.1
(क) B से Tl तक तथा
(ख) C से Pb तक की ऑक्सीकरण अवस्थाओं की भिन्नता के क्रम की व्याख्या कीजिए।
उत्तर:
(क) B से Tl तक (बोरॉन परिवार) ऑक्सीकरण अवस्था [Oxidation state from B to Tl (Boron family)]
बोरॉन परिवार (वर्ग 13) के तत्वों का विन्यास ns2p1 होता है। इसका तात्पर्य यह है कि बन्ध निर्माण के लिए तीन संयोजी इलेक्ट्रॉन उपलब्ध हैं। इन इलेक्ट्रॉनों का त्याग करके ये परमाणु अपने यौगिकों में +3 ऑक्सीकरण अवस्था प्रदर्शित करते हैं। यद्यपि इन तत्वों की ऑक्सीकरण-अवस्था में निम्नलिखित प्रवृत्ति प्रेक्षित होती है –
1. प्रथम दो तत्व बोरॉन तथा ऐलुमिनियम यौगिकों में केवल +3 ऑक्सीकरण अवस्था प्रदर्शित करते हैं, परन्तु शेष तत्वगैलियम, इण्डियम तथा थैलियम +3 ऑक्सीकरण अवस्था के साथ-साथ +1 ऑक्सीकरण अवस्था भी प्रदर्शित करते हैं अर्थात् से परिवर्ती ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं।
2. +3 ऑक्सीकरण अवस्था का स्थायित्व ऐलुमिनियम से आगे जाने पर घटता है तथा अन्तिम तत्व थैलियम की स्थिति में, +1 ऑक्सीकरण अवस्था, +3 ऑक्सीकरण अवस्था से अधिक स्थायी होती है। इसका अर्थ यह है कि TICI, TIC15 से अधिक स्थायी होता है।
(ख) से Pb तक (कार्बन परिवार) ऑक्सीकरण अवस्था [Oxidation state from C to Pb (Carbon family)]
कार्बन परिवार (समूह-14) के तत्वों का विन्यास ns2p2 होता है। स्पष्ट है कि इन तत्वों के परमाणुओं के बाह्यतम कोश में चार इलेक्ट्रॉन होते हैं। इन तत्वों द्वारा सामान्यतः +4 तथा +2 ऑक्सीकरण अवस्था दर्शाई जाती है। कार्बन ऋणात्मक ऑक्सीकरण अवस्था भी प्रदर्शित करता है।
चूंकि प्रथम चार आयनन एन्थैल्पी का योग अति उच्च होता है; अतः +4 ऑक्सीकरण अवस्था में अधिकतर यौगिक सहसंयोजक प्रकृति के होते हैं। इस समूह के गुरुतर तत्वों में Ge < Sn < Pb क्रम में +2 ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति बढ़ती जाती है।
सहसंयोजक कोश में ns2 इलेक्ट्रॉन के बन्धन में भाग नहीं लेने के कारण यह होता है। इन दो ऑक्सीकरण अवस्थाओं का सापेक्षिक स्थायित्व वर्ग में परिवर्तित होता है। कार्बन तथा सिलिकन मुख्यत: +4 ऑक्सीकरण अवस्था प्रदर्शित करते हैं। जर्मेनियम की +4 ऑक्सीकरण अवस्था स्थायी होती है, जबकि कुछ यौगिकों में +2 ऑक्सीकरण अवस्था भी मिलती है।
टिन ऐसी दोनों अवस्थाओं में यौगिकों बनाता है (+2 ऑक्सीकरण अवस्था में टिन अपचायक के रूप में कार्य करता है)। +2 ऑक्सीकरण अवस्था में लेड के यौगिक स्थायी होते हैं, जबकि इसकी +4 अवस्था प्रबल ऑक्सीकरण है। इस आधार पर स्पष्ट है कि –
- SnCl4 तथा PbCl4 की तुलना में SnCl2 तथा PbCl2 अधिक सरलता से बनते हैं।
- PbCl2, SnCl2, से अधिक स्थायी होता है चूँकि इसमें अक्रिय युग्म प्रभाव का परिमाण अधिक होता है।
चतुः संयोजी अवस्था में अणु के केन्द्रीय परमाणु पर आठ इलेक्ट्रॉन होते हैं। इलेक्ट्रॉन परिपूर्ण अणु होने के कारण सामान्यतया इलेक्ट्रॉनग्राही या इलेक्ट्रॉनदाता स्पीशीज की अपेक्षा इनसे नहीं की जाती है। यद्यपि कार्बन अपनी सहसंयोजकता +4 का अतिक्रमण नहीं कर सकता है, परन्तु समूह के अन्य तत्व ऐसा करते हैं।
यह उन तत्वों में d – कक्षकों की उपस्थिति के कारण होता है। यही कारण है कि ऐसे तत्वों के हैलाइड जल-अपघटन के उपरान्त दाता स्पीशीज (donor species) से इलेक्ट्रॉन ग्रहण करके संकुल बनाते हैं। उदाहरणार्थ-कुछ स्पीशीज; जैसे –
(SiF6)2-, (GeCl6)2- तथा Sn(OH)62- ऐती होती हैं, जिनके केन्द्रीय परमाणु sp3d2 संकरित होते हैं।
![]()
प्रश्न 11.2
TlCl3 की तुलना में BCl3 के उच्च स्थायित्व को आप कैसे समझाएँगे?
उत्तर:
बोरॉन (B) परमाणु की स्थिति में, अक्रिय युग्म प्रभाव नगण्य होता है। इसका अर्थ है कि इसके तीनों संयोजी इलेक्ट्रॉन (2s2px1) क्लोरीन परमाणुओं के साथ बन्ध बनाने के लिए उपलब्ध हैं। इसलिए BCl3 स्थायी होती है। यद्यपि थैलियम (Tl) की स्थिति में, संयोजी s-इलेक्ट्रॉन (6s2) अधिकतम अक्रिय युग्म प्रभाव अनुभव करते हैं। अतः केवल संयोजी p – इलेक्ट्रॉन (6p1) बन्ध के लिए उपलब्ध होते हैं। इन परिस्थितियो में TlCl अत्यधिक स्थायी होता है, जबकि TlCl3 अपेक्षाकृत बहुत कम स्थायी होता है। निष्कर्ष रूप में स्पष्ट है कि TlCl3 की तुलना में BCl, उच्च स्थायी होता है।
प्रश्न 11.3
बोरॉन ट्राइफ्लुओराइड लूईस अम्ल के समान व्यवहार क्यों प्रदर्शित करता है?
उत्तर:
बोरॉन ट्राइफ्लुओराइड BF3 अणु में F परमाणुओं के इलेक्ट्रॉनों से साझा करके केन्द्रीय बोरॉन परमाणु के चारों ओर इलेक्ट्रॉनों की संख्या 6 (तीन युग्म) होती है। अतः यह एक इलेक्ट्रॉन-न्यून अणु है तथा यह स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त करने के लिए एक इलेक्ट्रॉन युग्म ग्रहण करके लूईस अम्ल के समान व्यवहार प्रदर्शित करता है।
उदाहरणार्थ –
बोरॉन ट्राइफ्लुओराइड सरलतापूर्वक अमोनियाम से एक एकाकी इलेक्ट्रॉन युग्म ग्रहण करके BE3.NH3 उपसहसंयोजक यौगिक बनाता है।

प्रश्न 11.4
BCl3 तथा CCl4 यौगिकों का उदहारण देते हए जल के प्रति इनके व्यवहार के औचित्य को समझाइए।
उत्तर:
BCl3 में (B परमाणु ap2 – संकरित हैं), B परमाणु का अष्टक अपूर्ण है तथा इसका असंकरित 2p – कक्षक जल अणु से इलेक्ट्रॉन-युग्म ग्रहण करके योगात्मक उत्पाद बना सकता है।
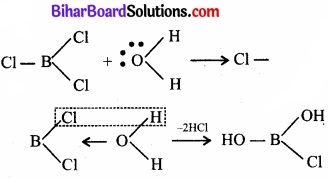
इस प्रकार जल से अभिक्रिया करने पर एक Cl परमाणु -OH समूह से प्रतिस्थापित हो जाता है। इसी प्रकार अन्य दो Cl परमाणु भी -OH समूहों से प्रतिस्थापित हो जाते हैं।
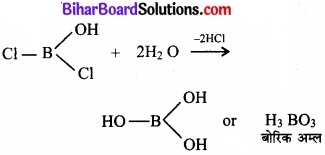
इससे प्रदर्शित होता है कि बोरॉन ट्राइक्लोराइड का जल-अपघटन हो जाता है, परन्तु यह CCl4 के साथ सम्भव नहीं है। कार्बन परमाणु का अष्टक पूर्ण होता है तथा H2O अणुओं के साथ योगात्मक उत्पाद बनने की कोई सम्भावना नहीं है। परिणामस्वरूप कार्बन टेट्राक्लोराइड जल-अपघटित नहीं होता। जल में मिलाने पर यह उसमें मिश्रित भी नहीं होता, अपितु एक पृथक तैलीय पर्त बनाता है।
![]()
प्रश्न 11.5
क्या बोरिक अम्ल प्रोटोनी अम्ल है? समझाइए।
उत्तर:
बोरिक अम्ल प्रोटोनी अम्ल नहीं है। यह एक लूईस अम्ल है तथा H2O अणु के हाइड्रॉक्सिल आयन से इलेक्ट्रॉन-युग्म ग्रहण करता है।
B(OH)3 + 2HOH → B(OH4)–] + H3O+
प्रश्न 11.6
क्या होता है, जब बोरिक अम्ल को गर्म किया जाता है?
उत्तर:
370K से अधिक ताप गर्म किए जाने पर बोरिक अम्ल (ऑर्थोबोरिक अम्ल) मेटाबोरिक अम्ल (HBO2) बनाता है, जो और अधिक गर्म करने पर बोरिक ऑक्साइड (B2O3) में परिवर्तित हो जाता है।
![]()
प्रश्न 11.7
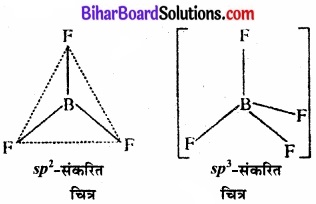
BF3 तथा BH–4 की आकृति की व्याख्या कीजिए। इन स्पीशीज में बोरॉन के संकरण को निर्दिष्ट कीजिए।
उत्तर:
बोरॉन ट्राइफ्लु ओराइड (Boron trifluoridie, BF3):
इसमें केन्द्रीय परमाणु बोरॉन है जिसका इलेक्ट्रॉनिक विन्यास 1s2, 2s2 2p1 है। तलस्थ अवस्था में इसमें केवल एक अयुग्मित इलेक्ट्रॉन है जिसके आधार पर केवल एक सहसंयोजक बन्ध ही बन सकता है। अतः BF3 अणु बनने में यह अवश्य ही उत्तेजित अवस्था में होगा जिस स्थिति में एक s – इलेक्ट्रॉन p – कक्षक में उन्नत हो जाएगा –

उत्तेजित बोरॉन में तीन अयुग्मित इलेक्ट्रॉन हैं जिससे यह तीन. सहसंयोजक बन्ध बना सकता है। तीन फ्लुओरीन BF3 में युग्मन के लिए तीन इलेक्ट्रॉन प्रदान करते हैं।

इसमें एक बन्ध s – इलेक्ट्रॉन के माध्यम से है तथा अन्य दो बन्ध दो p – इलेक्ट्रॉनों के माध्यम से है। अतः तीनों बन्ध समान नहीं होने चाहिए। ऽ तथा px व py कक्षकों की ऊर्जा का संचय होकर तीनों कक्षकों में बराबर राशि में वितरित हो जाता है। इस प्रकार तीन sp2 संकर कक्षकों का उद्भव होता है। इन कक्षकों के बीच 120° का कोण होता है जिससे इलेक्ट्रॉन युग्मों में पारस्परिक प्रतिकर्षण न्यूनतम रहता है।
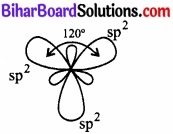
चित्र – sp2 – संकरण।
ये sp2 संकर कक्षक F परमाणुओं के कक्षकों के साथ अतिव्यापन करके बन्ध बनाते हैं। इस प्रकार BF3 में बन्ध कोण 120° होता है तथा अणु त्रिकोणीय व समतल होता है।

चित्र-बोरॉन ट्राइफ्जुओराइड की आकृति।
बोरॉन टेट्रा हाइड्राइडो ऋणायन (BH–4):
वर्ग -13 के तत्व MH3 प्रकार के हाइड्राइड बनाते हैं। ये हाइड्राइड दुर्बल लूईस अम्ल होते हैं तथा प्रबल लूईस क्षारकों (:B) के साथ MH3 : B प्रकार के योग-उत्पाद बनाते हैं (M = B, Al, Ga)। इन हाइड्राइडों का निर्माण इनके बाह्यतम कोश में उपस्थित रिक्त p – कक्षकों के कारण होता है। जो हाइड्राइड आयन (H–) से तुरन्त इलेक्ट्रॉन युग्म लेकर टेट्रा हाइड्राइडो ऋणायन बनाते हैं। BH–4 की संरचना संकरण के प्रकार के आधार पर निर्धारित की जा सकती है। संकरण का प्रकार निम्नलिखित सूत्र से ज्ञात किया जा सकता है –
H = \(\frac{1}{2}\) [V + M – C + A]
जहाँ H = संकरण में सम्मिलित कक्षकों की संख्या
V = केन्द्रीय परमाणु के संयोजी कोश में इलेक्ट्रॉनों की संख्या
M = एकल संयोजी परमाणुओं की संख्या
C = धनायन पर आवेश
A = ऋणायन पर आवेश
इस प्रकार
H = \(\frac{1}{2}\) [3 + 4 – 0 + 1] = 4
चूँकि संकरण में भाग लेने वाले कक्षकों की संख्या 4 है; अत: यह sp3 संकरण है। sp3 संकरण में एक s – कक्षक तथा तीन p – कक्षकों के सम्मिश्रण से चार समतुल्य संकर कक्षक बनते हैं। इन चारों कक्षकों में अल्पतम प्रतिकर्षण होने के लिए वे एक। समचतुष्फलक के चारों कोनों की ओर दिष्ट होते हैं तथा परस्पर 109°28′ का कोण बनाते हैं। अतः BH–4 की आकृति निम्नवत्
होगी –
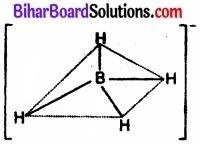
चित्र – [BH4]– की आकृति।
![]()
प्रश्न 11.8
एल्यूमीनियम के उभयधर्मी व्यवहार दर्शाने वाली अभिक्रियाएँ दीजिए।
उत्तर:
चूँकि एल्यूमीनियम अम्लों तथा ‘क्षारों दोनों से अभिक्रिया कर सकता है, अतः यह उभयधर्मी प्रवृत्ति का होता है; जैसे –

प्रश्न 11.9
इलेक्ट्रॉन न्यून यौगिक क्या होते हैं? क्या BCl3 तथा SiCl4 इलेक्ट्रॉन न्यून यौगिक हैं? समझाइये।
उत्तर:
इलेक्ट्रॉन न्यून यौगिक-ऐसे यौगिक जिनके अणुओं में केन्द्रीय परमाणु या अधिक इलेक्ट्रॉन-युग्मों को ग्रहण, करने की प्रवृत्ति हो, इलेक्ट्रॉन-न्यून यौगिक कहलाते हैं। इन्हें लूईस अम्ल भी कहते हैं।
BCl3 तथा SiCl4 दोनों इलेक्ट्रॉन-न्यून यौगिक हैं। B और Si परमाणुओं में क्रमशः रिक्त 2p – कक्षक तथा रिक्त 3d – कक्षक होते हैं। ये दोनों परमाणु इलेक्ट्रॉन-दाता स्पीशीज से इलेक्ट्रॉन ग्रहण करते हैं। अत: BCl3 तथा SiCl4 इलेक्ट्रॉन न्यून यौगिक है।
प्रश्न 11.10
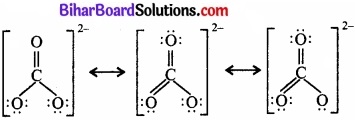
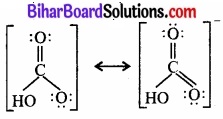
CO32- तथा HCO–3, की अनुनादी संरचनाएँ लिखिए।
उत्तर:
CO32- की अनुनादी संरचना
HCO2-3 की अनुनादी संरचना
प्रश्न 11.11
(क) CO32-, (ख) हीरा तथा (ग) ग्रेफाइट में कार्बन की संकरण-अवस्था क्या होती है?
उत्तर:
(क) CO32- में कार्बन की संकरण-अवस्था sp2 है।
(ख) हीरे में कार्बन की संकरण-अवस्था sp3 है।
(ग) ग्रेफाइट में कार्बन की संकरण-अवस्था sp2 है।
![]()
प्रश्न 11.12
संरचना के आधार पर हीरा तथा ग्रेफाइट के गुणों में निहित भिन्नता को समझाइए।
उत्तर:
हीरा तथा ग्रेफाइट में अन्तर:
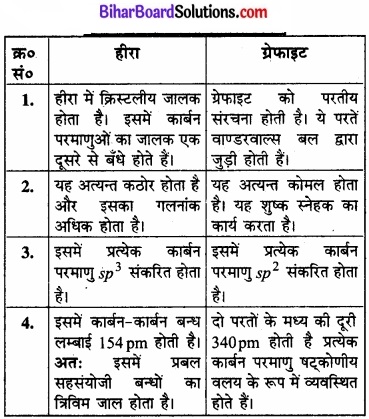
प्रश्न 11.13
निम्नलिखित कथनों को युक्तिसंगत कीजिए तथा रासायनिक समीकरण दीजिए –
(क) लेड (II) क्लोराइड Cl2 से क्रिया करके PbCl4 देता है।
(ख) लेड (IV) क्लोराइड ऊष्मा के प्रति अत्यधिक अस्थायी है।
(ग) लेड एक आयोडाइड Pbl4 नहीं बनाता है।
उत्तर:
(क) लेड (II) क्लोराइड Cl2 से क्रिया करके लेड (IV) क्लोराइड, PbCl4 देता है क्योंकि क्लोरीन एक प्रबलतम ऑक्सीकारक हैं।

(ख) चूँकि लेड IV ऑक्सीकरण अवस्था की तुलना में II ऑक्सीकरण अवस्था में अधिक स्थायी होता है; अत: लेड (IV) क्लोराइड ऊष्मा के प्रति अत्यधिक अस्थायी होता है। Pb (IV) क्लोराइड अपघटित होकर Pb (II) क्लोराइड बनाता है और Cl2 गैस मुक्त होती है।
![]()
(ग) चूँकि I– आयन के प्रबल अपचायक हैं और यह विलयन में Pb4+ आयन Pb2+ आयन में अपचयित कर देता हैं, अतः लेड एक आयोडाइड PbI4 नहीं बनाता है।

प्रश्न 11.14
BF3 में BF–4 में बन्ध लम्बाई क्रमशः 130 pm तथा 143 pm होने के कारण बताइए।
उत्तर:
BF3 में तथा BF4 में बोरॉन की संकरण – अवस्था निम्नवत् है –
अतः दिए गए दो फ्लुओराइडों के बन्ध लम्बाइयों में अन्तर बोरॉन की संक्रमण अवस्था में अन्तर के कारण होता है।
प्रश्न 11.15
B – Cl आबन्ध द्विध्रुव आघूर्ण रखता है, किन्तु BCl3 अणु का द्विध्रुव आघूर्ण शून्य होता है, क्यों?
उत्तर:
B – Cl बन्ध में एक निश्चित द्विध्रुव आघूर्ण होता है। दूसरी ओर BCl3 का द्विध्रुव आघूर्ण शून्य होता है क्योंकि इसका अणु समतलीय होता है जिसमें आबन्ध ध्रुवताएँ परस्पर निरस्त हो जाती हैं।
![]()
प्रश्न 11.16
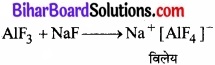
निर्जलीय (HF) में एल्यूमीनियम ट्राइफ्लुओराइड अविलेय हैं, परन्तु NaF मिलाने पर घुल जाता है। गैसीय BF3 को प्रवाहित करने पर परिणामी विलयन में से एल्यूमीनियम ट्राइफ्लुओराइड अवक्षेपित हो जाता है। इसका कारण बताइए।
उत्तर:
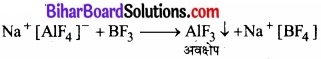
चूँकि एल्यूमीनियम ट्राइफ्लुओराइड (AIF3) की प्रकृति सहसंयोजी होती है, अत: यह निर्जलीय (HF) अधुलनशील है। यह NaF से अभिक्रिया के पश्चात् एक संकुल यौगिक बनाता है जो जल में विलेय है।
यह संकुल यौगिक को जलीय विलयन BF3 की वाष्प प्रवाहित करने पर तोड़ा जा सकता है। फलत: AIF3 पुन: अवक्षेपित हो जाता है।
प्रश्न 11.17
CO के विषैली होने का एक कारण बताइए।
उत्तर:
CO की अत्यंत विषैली प्रकृति हीमोग्लोबिन के साथ एक संकुल बनाने के कारण होती है जो ऑक्सीजन हीमोग्लोबिन संकुल से 300 गुना अधिक स्थाई होता है। यह लाल रक्त कोशिकाओं में उपस्थित हीमोग्लोबिन को शरीर में ऑक्सीजन प्रवाह को रोकती है। इससे दम घुटने लगता है और अंततः मृत्यु हो जाती है।
प्रश्न 11.18
CO2 की अधिक मात्रा भूमण्डलीय ताप वृद्धि के लिए उत्तरदायी कैसे है?
उत्तर:
CO2 में CH4 की तरह ऊष्मा अवशोषित करने की प्रवृत्ति होती है, जिसे हरित-ग्रह गैस करते हैं। इसी प्रवृत्ति के कारण CO2 की अधिक मात्रा भूमण्डलीय ताप वृद्धि के लिए उत्तरदायी होती है।
प्रश्न 11.19
डाइबोरेन तथा बोरिक अम्ल की संरचना समझाइए।
उत्तर:
(क) डाइबोरेन की संरचना:

चित्र – (क) डाइबोरेन (B2H6 ) की संरचना।
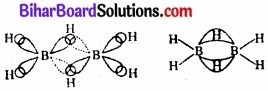
चित्र – (क) डाइबोरेन में बन्धन। डाइबोरेन में प्रत्येक बोरॉन परमाणु sp3 – संकरित होता है। इन चार sp3 – संकरित कक्षकों में से एक इलेक्ट्रॉन रहित होता है, जिसे बिन्दुकृत रेखाओं (Dotted Lines) द्वारा दर्शाया गया है। सिर वाले B – H समान्य द्विकेन्द्रीय-द्विइलेक्ट्रॉन (2e – 2e) बन्ध हैं, जबकि दो सेतुबन्ध B – H – B त्रिकेन्द्रीय-द्विइलेक्ट्रॉन (3e – 3e) है। इसे ‘केलाबन्ध’ (Banana Bond) भी कहते हैं।
डाइबोरेन की संरचना को चित्र (क) द्वारा दर्शाया गया है। इससे सिरे वाले चार हाइड्रोजन परमाणु तथा दो बोरॉन परमाणु एक ही तल में होते हैं। इस तल के ऊपर तथा नीचे दो सेतुबन्ध (bridging) हाइड्रोजन परमाणु होते हैं। सिरे वाले चार B-H बन्ध सामान्य द्विकेन्द्रीय-द्विइलेक्ट्रॉन (two centre-two electron) बन्ध भिन्न प्रकार के होते हैं, जिन्हें ‘त्रिकेन्द्रीयद्विइलेक्ट्रॉन बन्ध’ कहते हैं चित्र (ख)।
(ख) बोरिक अम्ल की संरचना:
ठोस अवस्था में बोरिक अम्ल की पीय संरचना होती है, जहाँ समतलीय BO3 की इकाइयाँ हाइड्रोजन बन्ध द्वारा एक-दूसरे से 3.18pm की दूरी पर जुड़ी रहती हैं।
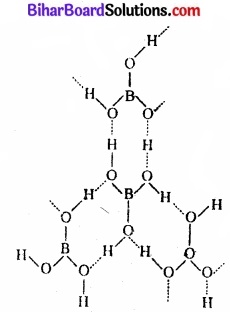
चित्र – (ख) बोरिक अम्ल की संरचना में बिन्दुकृत रेखाएँ हाइड्रोजन आबन्ध को प्रदर्शित करती हैं।
![]()
प्रश्न 11.20
क्या होता है, जब –
(क) बोरेक्स को अधिक गर्म किया जाता है।
(ख) बोरिक अम्ल को जल में मिलाया जाता है।
(ग) एल्यूमीनियम की तनु NaOH से अभिक्रिया कराई जाती है।
(घ) BF3 की क्रिया अमोनिया से की जाती है।
उत्तर:
(क) पहले यह जल के अणु का निष्कासन करके फूल जाता है। पुनः गर्म करने पर यह एक पारदर्शी द्रव में परिवर्तित हो जाता है, जो काँच के समान एक ठोस में परिवर्तित हो जाता है। इसे बोरेक्स मनका कहते हैं।
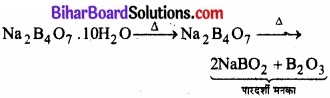
(ख) यह जल में घुल जाता है। क्योंकि यह इलेक्ट्रॉन-न्यून प्रकृति का होता है।
B(OH)3 + H – OH → [B(OH)4]– + H+
(ग) एल्यूमीनियम NaOH विलयन में घुलकर एक विलेय संकुल बनाता है तथा हाइड्रोजन गैस मुक्त करता है।
2Al (s) + 2NaOH (aq) + 6H2O (l) → 2Na+[Al(OH)4]– (aq) + 3H2 (g)
(घ) BF3 (लूईस अम्ल) NH3 (लूईस-क्षार) के साथ योगत्मक यौगिक बनाता है।

प्रश्न 11.21
निम्नलिखित अभिक्रियाओं को समझाइए –
(क) कॉपर की उपस्थिति में उच्च ताप पर सिलिकन को मेथिल क्लोराइड के साथ गर्म किया जाता है।
(ख) सिलिकॉन डाऑक्साइड की क्रिया हाइड्रोजन फ्लु ओराइड के साथ की जाती है।
(ग) CO को ZnO के साथ गर्म किया जाता है।
(घ) जलीय ऐलुमिना की क्रिया जलीय NaOH के साथ की जाती है।
उत्तर:
(क) सिलिकन कॉपर (उत्प्रेरक) की उपस्थिति में मेथिल क्लोराइड के साथ 570K पर गर्म करने पर डाइमेथिल डाइक्लोरोसिन बनाता है। इसके जल अपघटन पर संघनन बहुलीकरण द्वारा श्रृंखला बहुलक प्राप्त होते हैं।
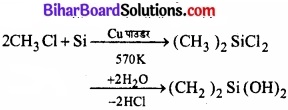
(ख) सिलिकन टेट्राफ्लुओराइड (SiF4) बनाता है।
SiO2 + 4HF → SiF4 + 2H2O
(ग) CO (प्रबल अपचायन) द्वारा ZnO का अपचयन Zn में हो जाता है।
![]()
(घ) क्रिया करके एक घुलनशील संकुल बनाते हैं।
Al2O3 (s) + 2NaOH(aq) + 3H22 (l) → 2Na [AI(OH)4] (aq)
![]()
प्रश्न 11.22
कारण बताइए –
(क) सान्द्र HNO3 का परिवहन ऐलुमिनियम के पात्र द्वारा किया जा सकता है।
(ख) तनु NaOH तथा ऐलुमिनियम के टुकड़ों के मिश्रण का प्रयोग अपवाहिका खोलने के लिए किया जाता है।
(ग) ग्रेफाइट शुष्क स्नेहक के रूप में प्रयुक्त होता है।
(घ) हीरा का प्रयोग अपघर्षक के रूप में होता है।
(ङ) वायुयान बनाने में ऐलुमिनियम मिश्रधातु का उपयोग होता है।
(घ) जल को ऐलुमिनियम पात्र में पूरी रात नहीं रखना चाहिए।
(छ) संचरण केवल बनाने में ऐलुमिनियम तार का प्रयोग होता है।
उत्तर:
(क) सान्द्र HNO3 प्रारम्भ में ही ऐलुमिनियम से क्रिया करके ऐलुमिनियम ऑक्साइड (Al2O3) बना लेता है। जो पात्र के भीतर एक रक्षी-लेपन कर देता है। इस प्रकार धात्विक पात्र निष्क्रिय (passive) हो जाता है तथा फिर अम्ल से क्रिया नहीं करता। इसलिए अम्ल का परिवहन ऐलुमिनियम के पात्र द्वारा सुरक्षापूर्वक किया जा सकता है।
(ख) ऐलुमिनियम तनु NaOH में घुलकर H2 मुक्त करता है। यह हाइड्रोजन गैस अपवाहिका खोलने में सहायता करती
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(ग) प्रेफाइट में sp2 – संकरित कार्बन होता है तथा इसकी पीय संरचना होती है। व्यापक पृथक्करण तथा दुर्बल अन्तरपीय बन्धों के कारण इसकी दो समीपवर्ती पर्ते एक-दूसरे पर सरलतापूर्वक फिसल जाती हैं। इस कारण इसे शुष्क स्नेहक की भाँति उन मशीनों में प्रयुक्त किया जा सकता है जिनमें किसी कारणवश तैलीय स्नेहक प्रयुक्त न किए जा सकते हों।
(घ) हीरा समस्त ज्ञात पदार्थों में कठोरतम पदार्थ होता है। अतः इसका प्रयोग अपघर्षक (abrasive) तथा काँच काटने में किया जाता है।
(ङ) ऐलुमिनियम मिश्रधातु – मैग्नोलियम तथा ड्यूरैलियम जिनमें लगभग 95% धातु होती है, को वायुयान बनाने में प्रयोग किया जाता है। इसका कारण यह है कि ये हल्के, परन्तु मजबूत होते हैं। इसके अतिरिक्त इन पर जंग भी नहीं लगता है।
(च) जल को ऐलुमिनियम पात्र में पूरी रात नहीं रखना चाहिए, क्योंकि लम्बे समय तक नमी तथा ऑक्सीजन से धातु संक्षारित हो सकती है।
(छ) ऐलुमिनियम सामान्यतया वायु तथा नमी से प्रभावित नहीं होती तथा इसकी विद्युत-चालकता कॉपर से दोगुनी होती है। इसलिए संचरण केबल बनाने में ऐलुमिनियम तार का प्रयोग होता है।
प्रश्न 11.23
कार्बन से सिलिकॉन तक आयनीकरण एन्थैल्पी में प्रघटनीय कमी होती है। क्यों?
उत्तर:
कार्बन से सिलिकन तक आयनीकरण में प्रघटनीय कमी होती है; क्योंकि कार्बन की परमाणु त्रिज्या (77pm) की तुलना में सिलिकन की परमाणु त्रिज्या अधिक (118 pm) होती है। इसलिए इलेक्ट्रॉनों का निष्कासन सरलतापूर्वक हो जाता है। सिलिकन से जर्मेनियम तक आयनन एन्थैल्पी में कमी प्रघटनीय नहीं होती; क्योंकि तत्वों के परमाणु आकार एकसमान रूप से बढ़ते हैं।
![]()
प्रश्न 11.24
Al की तुलना में Ga की कम परमाणवीय त्रिज्या को आप कैसे समझाएँगे?
उत्तर:
समूह में नीचे जाने पर प्रत्येक क्रमागत सदस्य में इलेक्ट्रॉनों का एक कोश जुड़ता है। आंतरिक कोड के इलेक्ट्रॉनिक विन्यास यह देखा जा सकता है कि Ga में उपस्थित 10d इलेक्ट्रॉन बढ़े हुए नाभिकीय आवेश की तुलना में बाह्य इलेक्ट्रॉनों पर दुर्बल परीक्षण प्रभाव डाले हैं। फलत: Ga की परमाणवीय त्रिज्या AI की तुलना में कम होती है।
प्रश्न 11.25
अपररूप क्या होता है? कार्बन के दो महत्त्वपूर्ण अपररूप हीरा तथा ग्रेफाइट की संरचना का चित्र बनाइए। इन दोनों अपररूपों के भौतिक गुणों पर संरचना का क्या प्रभाव पड़ता है।
उत्तर:
अपररूप:
प्रकृति में शुद्ध कार्बन दो रूपों में पाया जाता है:
हीरा तथा ग्रेफाइट। यदि हीरे अथवा ग्रेफाइट को वायु में अत्यधिक गर्म किया जाए तो यह पूर्ण ग्रेफाइट की समान मात्रा दहन की जाती है, तब कार्बन डाइ-ऑक्साइड की बराबर मात्रा उत्पन्न होती है तथा कोई अवशेष नहीं बचता। इन तथ्यों से स्पष्ट है कि हीरा तथा ग्रेफाइट रासायनिक रूप से एकसमान है तथा केवल परमाणु से बने हैं। इनके भौतिक गुण अत्यधिक भिन्न होते हैं। अतः प्रकार के गुणों को प्रदर्शित करने वाले तत्त्वों को अपररूप कहते हैं।
हीरा:
हीरा में क्रिस्टलीय जालक होता है। इसमें प्रत्येक परमाणु sp3 – संकरित होता है तथा चतुष्फलकीय ज्यामिति से अन्य चार कार्बन परमाणु से जुड़ा रहता है। इसमें कार्बन-कार्बन बन्ध लम्बाई 154 pm होती है। कार्बन परमाणु द्विक (space) में दृढ़ त्रिविमीय जालक (rigid three dimensional network) का निर्माण करते हैं।
इस संरचना में सम्पूर्ण जालक में दिशात्मक सहसंयोजक बन्ध उपस्थित रहते हैं। इस प्रकार विस्तृत सहसंयोजक बन्ध को तोड़ना कठिन कार्य होता है। अतः हीरा पृथ्वी पर पाया जाने वाला सर्वाधिक कठोर पदार्थ है। इसका उपयोग धार तेज करने के लिए अपघर्षक (abrasive) के रूप में, रूपदा (dies) बनाने में तथा विद्युत-प्रकाश लैम्प में टंगस्टन तन्तु (filament) बनाने में होता है।
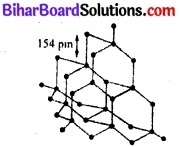
चित्र-हीरे की संरचना।
ग्रेफाइट ग्रेफाइट की परतीय संरचना (layered structure) होती है। ये पर्ते वान्डरवाल बल द्वारा जुड़ी रहती हैं। इस कारण ग्रेफाइट चिकना (slippery) तथा मुलायम (soft) होता है। दो पर्तों के मध्य की दूरी 340pm होती है। प्रत्येक पर्त में कार्बन परमाणु षट्कोणीय वलय (hexagonal rings) के रूप में व्यवस्थित होते हैं, जिसमें C – C बन्ध लम्बाई 141.5pm होती है। षट्कोणीय वलय में प्रत्येक परमाणु (sp2) संकरित होता है।
प्रत्येक कार्बन परमाणुओं से तीन सिग्मा बन्ध बनाता है। इसका चौथा इलेक्ट्रॉन π – बन्ध बनता है। सम्पूर्ण परत में इलेक्ट्रॉन विस्थानीकृत होते हैं। इलेक्ट्रॉन गतिशील होते हैं; अत: ग्रेफाइट विद्युत का सुचालक होता है। उच्च ताप पर जिन मशीनों में तेल का प्रयोग स्नेहक (lubricant) के रूप में नहीं हो सकता है, उनमें ग्रेफाइट शुष्क स्नेहक का कार्य करता है।
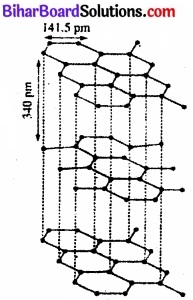
![]()
प्रश्न 11.26
(क) निम्नलिखित ऑक्साइड को उदासीन, अम्लीय, क्षारीय तथा उभयधर्मी ऑक्साइड के रूप में वर्गीकृत कीजिए –
CO, B2O3, SiO2, CO2, Al2O3, PbO2, Tl2O3
(ख) इनकी प्रकृति को दर्शाने वाली रासायनिक अभिक्रिया लिखिए।
उत्तर:
(क) उदासीन ऑक्साइड : Co
अम्लीय ऑक्साइड : SiO2, CO2, B2O3
क्षारीय ऑक्साइड : Tl2O3 + PbO2
उभयधर्मी ऑक्साइड : Al2O3
(ख) CO – उदासीन
B2O3 – अम्लीय
B2O3 + Cu0 → Cu(BO2)2
SiO2 – अम्लीय
SiO2 + CaO → CaSiO3
CO2 – अम्लीय
NaOH + CO2 → NaHCO3
2NaOH + CO2 → Na2CO3 + H2O
Al2O3 – उभयधर्मी
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
PbO2 – क्षारीय
PbO2 + HCl → PbCl4 + 2H20
Tl2O3 – क्षारीय
Tl2O3 + 8H2SO4 → Tl2(SO4)3 + 3H2O
![]()
प्रश्न 11.27
कुछ अभिक्रियाओं में थैलियम, ऐलुमिनियम से समानता दर्शाता है, जबकि अन्य में यह समूह I के धातुओं से समानता दर्शाता है। इस तथ्य को कुछ प्रमाणों के द्वारा सिद्ध करें।
उत्तर:
थैलियम की ऐलुमिनियम से समानता (Similarities of Thallium with Aluminium):
ऐलुमिनियम अपने यौगिकों में +3 ऑक्सीकरण अवस्था प्रदर्शित करता है। थैलियम, वर्ग-13 का अन्तिम तत्व, अक्रिय युग्म प्रभाव के कारण + 3 तथा +1 ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है। अतः ये धातुएँ +3 ऑक्सीकरण अवस्था में समानता रखती हैं। यद्यपि ये +1 ऑक्सीकरण अवस्था में भिन्नता दर्शाती हैं। इनमें समानता के कुछ बिन्दु निम्नलिखित हैं –
- दोनों का बाह्यतम इलेक्ट्रॉनिक विन्यास ns2np1 होता है।
- दोनों वायु में ऑक्साइड बनने के कारण धूमिल पड़ जाती है।
- Al तथा Tl दोनों के फ्लुओराइड आयनिक होते हैं तथा इनका गलनांक उच्च होता है।
थैलियम की समूह – I के धातुओं से समानता (Similarities of Thallium with group – I metals):
थैलियम + 1 ऑक्सीकरण अवस्था में समूह – I की धातुओं से समानता दर्शाता है। इनमें समानता के कुछ बिन्दु निम्नलिखित –
- NaOH के समान, Tl(OH) जल में विलेय होकर प्रबल क्षारीय विलयन देता है।
- क्षार धातुओं के समान, थैलियम (TI) ऐलुमिनियम लवणों के साथ द्विक-लवण बनाता है।

प्रश्न 11.28
जब धातु x की क्रिया सोडियम हाइड्रॉक्साइड के साथ की जाती है तो श्वेत अवक्षेप (A) प्राप्त होता है, जो NaOH के आधिक्य में विलेय होकर विलेय संकुल (B) बनाता है। यौगिक (A) तनु HCl में घुलकर यौगिक (C) बनाता है। यौगिक (A) को अधिक गर्म किए जाने पर यौगिक (D) बनता है, जो एक निष्कर्षित धातु के रूप में प्रयुक्त होता है। X, A, B, C तथा D को पहचानिए तथा इनकी पहचान के समर्थन में उपयुक्त समीकरण दीजिए।
उत्तर:
1. एल्यूमीनियम (X) को NaOH के साथ गर्म करने पर यह Al(OH)3 का सफेद अवक्षेप बनाता है अर्थात् यौगिक (A) बनाता है, जो NaOH के आधिक्य में घुलकर विलेय संकर (B) बनाता है।

2. यौगिक (A) तनु HCl में घुलकर एल्यूमीनियम क्लोराइड (C) बनाता है।

3. यौगिक (A) अर्थात् Al(OH), को गर्म करने पर ऐलुमिना (D) में बदल जाता है।

प्रश्न 11.29
निम्नलिखित से आप क्या समझते हैं?
(क) अक्रिय युग्म प्रभाव
(ख) अपररूप
(ग) श्रृंखलन।
उत्तर:
(क) अक्रिय युग्म प्रभाव (Inert pair effect):
कोश इलेक्ट्रॉनिक विन्यास, (n-1)d10 ns2 np1 वाले तत्व में, d – कक्षक के इलेक्ट्रॉन दुर्बल परिरक्षण प्रभाव प्रस्तावित करते हैं। इसलिए ns2 इलेक्ट्रॉन नाभिक के धनावेश द्वारा अधिक दृढता से बँधे रहते हैं। इस प्रबल आकर्षण के परिणामस्वरूप, ns2 इलेक्ट्रॉन युग्मित रहते हैं तथा बन्ध में भाग नहीं लेते हैं अर्थात् अक्रिय रहते हैं। यह प्रभाव अक्रिय युग्म प्रभाव कहलाता है। इस स्थिति में, ns2np1 विन्यास में, तीन इलेक्ट्रॉनों में से केवल एक इलेक्ट्रॉन बन्ध-निर्माण में भाग लेता है।
(ख) अपररूप (Allotropes):
किसी तत्व का समान रासायनिक अवस्था में दो या अधिक भिन्न-रूपों में पाया जाना अपररूपता कहलता है। तत्व के ये विभिन्न रूप अपररूप कहलाते हैं। किसी तत्व के सभी अपररूपों के समान रासायनिक गुण होते हैं, परन्तु इनके भौतिक गुणों में अन्तर होता है।
(ग) श्रृंखलन (Catenation):
कार्बन में अन्य परमाणुओं के साथ सहसंयोजक बन्ध द्वारा जुड़कर लम्बी श्रृंखला या वलय बनाने की प्रवृत्ति होती है। इस प्रवृत्ति को श्रृंखलन कहते हैं। C – C बन्ध अधिक प्रबल होने के कारण ऐसा होता है।
![]()
प्रश्न 11.30
एक लवण x निम्नलिखित परिणाम देता है –
(क) इसका जलीय विलयन लिटमस के प्रति क्षारीय होता है।
(ख) तीव्र गर्म किए जाने पर यह काँच के समान ठोस में स्वेदित हो जाता है।
(ग) जब x के गर्म विलयन में सान्द्र H2SO4 मिलाया जाता है तो एक अम्ल Z का श्वेत क्रिस्टल बनता है।
उपरोक्त अभिक्रियाओं के समीकरण लिखिए और X, Y तथा Z को पहचानिए।
उत्तर:
उपरोक्त परिणामों से स्पष्ट है कि लवण X बोरेक्स (Na2B4O7) है।
(क) बोरेक्स का जलीय विलयन क्षारीय प्रकृति का होता है, जो लाल लिटमस को नीला कर देता है।

(ख) बोरेक्त तीव्र गर्म किए जाने पर यह स्वेदित हो जाता है, जो क्रिस्टलन जल के अणु खोकर ठोस (Y) बनाता है।
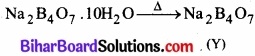
(ग) बोरेक्स सान्द्र H2SO4 के साथ अभिक्रिया करने पर बोरिक अम्ल (H3BO3) बना है। जब इसे क्रिस्टलीकृत किया जाता है तो यह श्वेत क्रिस्टलों (Z) के रूप में प्राप्त है।

प्रश्न 11.31
सन्तुलित समीकरण दीजिए –
(क) BF3 + LIH →
(ख) B2H6 + H2O →
(ग) NaH + B2H6 →
(घ)
![]()
(ङ) Al + NaOH →
(च) B2H6 + NH3 →
उत्तर:
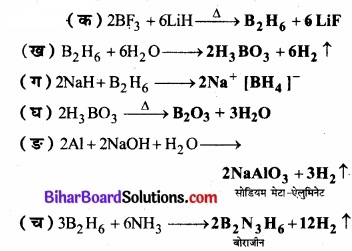
![]()
प्रश्न 11.32
CO तथा CO2 प्रत्येक के संश्लेषण के लिए एक प्रयोगशाला तथा एक औद्योगिक विधि दीजिए।
उत्तर:
1. कार्बन मोनो-ऑक्साइड (CO)
प्रयोगशाला विधि:
सान्द्र H2SO4 का 273K पर फार्मिक अम्ल के द्वारा निर्जलीकरण कराने पर अल्प मात्रा में शुद्ध CO प्राप्त होती हैं।
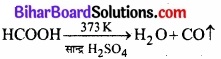
औद्योगिक विधि:
औद्योगिक रूप से कोक पर भाप प्रवाहित करके बनाया जाता है। इस प्रकार CO तथा N2 का मिश्रण प्राप्त होता है। इसे प्रोड्यूसर गैस कहते हैं।
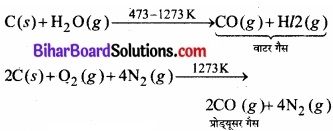
2. कार्बन डाइऑक्साइड (CO2)
प्रयोगशाला विधि:
प्रयोगशाला में इसे कैल्शियम कार्बोनेट पर तनु HCl की अभिक्रिया द्वारा बनाया जाता है।
CaCO3 (g) + 2HCl (aq) → CaCl2 (aq) + CO2 (g) + H2O (l)
औद्योगिक विधि:
इसे चूना पत्थर को गर्म करके बनाया जाता है।
![]()
प्रश्न 11.33
बोरेक्स के जलीय विलयन की प्रकृति कौन-सी होती है –
(क) उदासीन
(ख) उभयधर्मी
(ग) क्षारीय
(घ) अम्लीय
उत्तर:
(ग) क्षारीय।
![]()
प्रश्न 11.34
बोरिक अम्ल के बहुलकीय होने का कारण –
(क) इसकी अम्लीय प्रकृति है।
(ख) इसमें हाइड्रोजन बन्धों की उपस्थिति है।
(ग) इसकी एकक्षारीय प्रकृति है।
(घ) इसकी ज्यामिति है।
उत्तर:
(ख) इसमें हाइड्रोजन बन्धों की उपस्थिति है।
प्रश्न 11.35
डाइबोरेन में बोरॉन का संक्रमण कौन-सा होता है –
(क) sp
(ख) sp2
(ग) sp3
(घ) dsp2
उत्तर:
(ग) sp3
प्रश्न 11.36
ऊष्मागतिकीय रूप से कार्बन का सर्वाधिक स्थायी रूप कौन-सा है –
(क) हीरा
(ख) ग्रेफाइट
(ग) फुलरीन्स
(घ) कोयला
उत्तर:
(ख) ग्रेफाइट।
![]()
प्रश्न 11.37
निम्नलिखित में से समूह – 14 के तत्वों के लिए कौन-सा कथन सत्य है –
(क) +4 ऑक्सीकरण प्रदर्शित करते हैं।
(ख) +2 तथा +4 ऑक्सीकरण अवस्था प्रदर्शित करते हैं
(ग) M2- तथा M4- आयन बनाते हैं
(घ) M2+ तथा M4+ आयन बनाते हैं
उत्तर:
(ख) +2 तथा +4 ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
प्रश्न 11.38
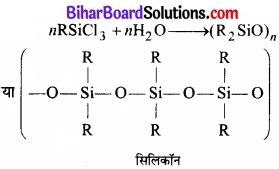
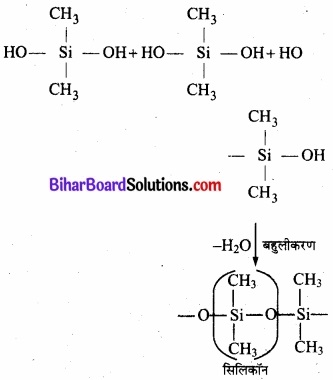
यदि सलिकॉन निर्माण में प्रारम्भिक पदार्थ RSiCl3 है तो बनने वाले उत्पाद की संरचना बताइए।
उत्तर: