BSEB Bihar Board 12th Chemistry Important Questions Long Answer Type Part 1 are the best resource for students which helps in revision.
Bihar Board 12th Chemistry Important Questions Long Answer Type Part 1
प्रश्न 1.
उत्प्रेरण से आप क्या समझते हैं ? समांग और विषमांग उत्प्रेरण की परिभाषा लिखें एवं इनके एक-एक उदाहरण दें।
उत्तर:
उत्प्रेरण : वह बाह्य पदार्थ जो अपनी अल्प मात्रा में उपस्थिति मात्र से किसी रासायनिक अभिक्रिया के वेग को परिवर्तित (घटा या बढ़ा देता है) कर देता है और स्वयं अभिक्रिया के अन्त में भार और रासायनिक संघटन की दृष्टि से अपरिवर्तित रहता है उत्प्रेरक कहलाता है और उत्प्रेरक द्वारा रासायनिक अभिक्रिया के वेग में परिवर्तन की यह घटना उत्प्रेरक कहलाता है।
उदाहरण- (i) पोटैशियम क्लोरेट को अकेले गर्म करने पर यह लगभग 360°C तापमान पर मंद गति से विघटित कर अल्प मात्रा में ऑक्सीजन गैस मुक्त करता है। लेकिन पोटैशियम क्लोरेट में उसकी मात्रा के \(\frac{1}{4}\) भाग मैगनीज डाइऑक्साइड मिलाकर मिश्रण को गर्म करने पर यह 250°C पर ही तीव्र गति से विघटित होकर ऑक्सीजन गैस की पर्याप्त मात्रा मुक्त करता है।
![]()
अभिक्रिया के फलस्वरूप मैंगनीज डाइऑक्साइड में किसी प्रकार का कोई परिवर्तन नहीं होता .. है। इसलिए यह यहाँ एक उत्प्रेरक का कार्य करता है। MnO2 के द्वारा इस अभिक्रिया के वेग के बढ़ने की यह घटना उत्प्रेरण कहलाती है।
समांग उत्प्रेरण (Homogeneous catalysis) : वह उत्प्रेरण जिसमें अभिकर्मक और उत्प्रेरक दोनों एक ही प्रावस्था में होते हैं और समांग प्रतिकारी मिश्रण (Reacting mixture) बनाते हैं। समांग उत्प्रेरण कहलाता है।
उदाहरण- सीस कक्ष विधि के द्वारा सल्फ्यूरिक अम्ल के उत्पादन में नाइट्रिक ऑक्साइड उत्प्रेरक की उपस्थिति में SO2 और O2 आपस में संयोग कर SO3 बनाते हैं।
2SO2 + O2 + [NO] → 2SO2 + [NO]
चूँकि इस अभिक्रिया में अभिकर्मक और प्रतिफल सभी एक गैसीय प्रावस्था में है। अतः यह समांग उत्प्रेरण का एक उदाहरण है।
विषमांग उत्प्ररेण (Heterogeneous catalysis) : वह उत्प्रेरण जिसमें अभिकर्मक और उत्प्रेरक दोनों भिन्न-भिन्न प्रावस्थाओं में होते हैं, विषमांग उत्प्रेरण कहलाता है।
उदाहरण : संपर्क विधि द्वारा सल्फ्यूरिक अम्ल के उत्पादन में सूक्ष्म विभाजित प्लैटिनम उत्प्रेरक की उपस्थिति में SO2 और O2 अभिक्रिया कर SO3 बनाते हैं।
2SO2 + O2 + [Pt] → 2SO3 + [Pt]
चूँकि इस अभिक्रिया में अभिकर्मक गैसीय अवस्था में हैं और उत्प्रेरक ठोस अवस्था में है, प्रतिकारी निकाय विषमांग होता है। अंतः यह अभिक्रिया विषमांग उत्प्रेरण का एक उदाहरण है।
प्रश्न 2.
निम्न के संदर्भ में वर्ग 15 के तत्त्वों के सामान्य विशेषताओं का वर्णन करें- (i) इलेक्ट्रॉनिक विन्यास, (ii) ऑक्सीकरण अवस्था, (iii) परमाणु का आकार, (iv) आयनन इंथैल्पी और (v) विद्युत ऋणात्मकता।
उत्तर:
(i) इलेक्ट्रॉनिक विन्यास : वर्ग 15 के सभी तत्त्वों N, P, As, Sb एवं Bi के संयोजी शेल का विन्यास nsenp होता है। ns सबशेल पूरा भरा हुआ है और np सबशेल आधा भरा हुआ है। यही कारण है कि इनका इलेक्ट्रॉनिक विन्यास स्थायी होता है।
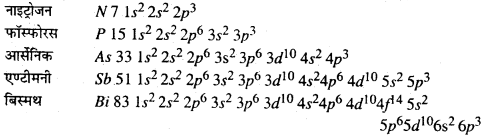
(ii) ऑक्सीकरण अवस्था : इन तत्त्वों के सामान्य ऑक्सीकरण अवस्था –3, +3, +5 होते हैं। -3ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति N से Bi तक घटती जाती है। नाइट्रोजन +5 ऑक्सीकरण अवस्था प्रदर्शित नहीं करता है क्योंकि इसके संयोजी शेल में केवल चार (एक S और तीन p) ऑर्बिटल होते हैं। +5 ऑक्सीकरण अवस्था का स्थायित्व नीचे जाने पर घटता है जबकि +3 का स्थायित्व बढ़ता है। ऐसा भारी तत्त्वों में पाये जाने से निष्क्रिय युग्म प्रभाव के कारण होता है। नाइट्रोजन +1, +2 और +4 ऑक्सीकरण अवस्था भी प्रदर्शित करता है जब यह ऑक्सीजन के साथ अभिक्रिया करता है। कुछ ऑक्सी अम्लों में फॉस्फोरस भी +1 और +4 ऑक्सीकरण अवस्था प्रदर्शित करता है।
(iii) परमाणु का आकार : परमाणु का आकार N से Bi तक बढ़ता जाता है क्योंकि प्रत्येक दशा में एक नया शेल जुटता है। N से P तक सहसंयोजी क्रिया अधिक बढ़ता है जबकि As से Bi तक यह वृद्धि कम होती है। ऐसा d और f सबशेल के पूरा भरा रहने के कारण होता है।
(iv) आयनन इंथैल्पी : वर्ग 14 के तत्वों की तुलना में वर्ग 15 के तत्त्वों को आयनन इंथैल्पी बहुत अधिक होता है। ऐसा परमाणु के आकार के छोटा होने तथा p सबशेल के ठीक आधा भरा रहने के कारण अतिरिक्त स्थायित्व के कारण होता है। इसका मान अन्य वर्गों की तरह N से Bi तक घटता जाता है।
(v) विद्युत ऋणात्मकता : विद्युत ऋणात्मकता का मान N से Bi तक घटता जाता है। भारी तत्त्वों के दशा में यह अन्तर कम होता है।
प्रश्न 3.
औद्योगिक पैमाने पर नाइट्रिक अम्ल के उत्पादन के ओस्टवाल्ड विधि के सिद्धान्त का वर्णन करें।
उत्तर:
हवा के ऑक्सीजन द्वारा प्लैटिनम उत्प्रेरक की उपस्थिति में अमोनिया का ऑक्सीकरण करने पर नाइट्रिक ऑक्साइड बनता है।
![]()
यह अभिक्रिया ऊष्माक्षेपी है तथा इसमें आयतन में वृद्धि होती है। अतः गैसीय मिश्रण को 6 से 7 वायुमंडलीय दाब पर संपीड़ित कर अभिक्रिया का ताप 700-800°C रखा जाता है। प्लैटिनम की तार की जाली का उपयोग उत्प्रेरक के रूप में किया जाता है। यह अभिक्रिया उत्क्रमणीय है। अत: NO के बनते ही उसे शीघ्र ही परिवर्तक से हटा दिया जाता है जिससे वह पुन: NH3 में परिवर्तित न हो सके।
नाइट्रिक ऑक्साइड को 200°C से 300°C तक ठंढा करने पर वह हवा के ऑक्सीजन द्वारा नाइट्रोजन डाइऑक्साइड में परिणत हो जाता है।
![]()
नाइट्रोजन डाइऑक्साइड जल से अभिक्रिया कर नाइट्रिक अम्ल बनाता है।
3NO2 + H2O → 2HNO3 + NO
मुक्त नाइट्रिक ऑक्साइड पुनः ऑक्सीकृत होकर नाइट्रोजन डाइऑक्साइड में परिणत होता है जो जल से अभिक्रिया कर नाइट्रिक अम्ल बनाता है।
प्रश्न 4.
फॉस्फोरस के विभिन्न ऑक्सी अम्लों के नाम एवं सूत्र लिखें।
उत्तर:
फॉस्फोरस के विभिन्न ऑक्सी अम्लों के नाम एवं सूत्र निम्न प्रकार हैं-
हाइपो फॉस्फोरस अम्ल H3PO2
ऑर्थो फॉस्फोरिक अम्ल H3PO4
ऑर्थो फॉस्फोरस अम्ल H3PO3
पायरोफॉस्फोरिक अम्ल H4P2O4
हाइपो फॉस्फोरिक अम्ल H4P2O6
मेटाफॉस्फोरिक अम्ल HPO3
पायरोफॉस्फोरस अम्ल H4P2O5
प्रश्न 5.
प्रयोगशाला में सल्फर डाइऑक्साइड कैसे बनाया जाता है ? इसके गुणों एवं उपयोगों का वर्णन करें।
उत्तर:
प्रयोगशाला में सल्फर डाइऑक्साइड बनाने के लिए ताँबे को सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म किया जाता है।
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
इस मुख्य अभिक्रिया के अतिरिक्त अन्य अभिक्रियाएं भी होती हैं। अन्य अभिक्रियाओं के कारण क्यूप्रस सल्फाइड बनता है जिसके कारण अवशिष्ट पदार्थ काला होता है।
5 Cu + 4H2SO4 → Cu2S + 3CuSO4 + 4H2O
जिंक ब्लेण्ड, लौह पायराइट एवं ताम्र पायराइट को हवा में जलाने पर सल्फर डाइऑक्साइड बनता है।
2ZnS + 3O2 → 2ZnO + 2SO2
4FeS + 11O2 → 2Fe2O3 + 8SO2
2 CuFeS2 + O2 → Cu2S + 2FeS + SO2
SO2 के गुण-(i) जल से अभिक्रिया : जल में घुलकर यह सल्फ्यूरस अम्ल बनाती है . जिसके फलस्वरूप जलीय विलयन अम्ल जैसा आचरण करता है।
SO2 + H2O → H2SO3
(ii) कॉस्टिक क्षार से अभिक्रिया : अलग-अलग दशाओं में क्षारों से अभिक्रिया कर सल्फाइट या बाइसल्फाइट लवण बनाता है।
![]()
2NaOH + SO2 → Na2SO3 + H2O
गैस के आधिक्य में बाइसल्फाइट लवण बनता है।
KOH + SO2 → KHSO3
NaOH + SO2 → NaHSO3
(iii) बोरियम हाइड्रॉक्माइड से अभिक्रिया : Ba(OH)2 के विलयन में SO2 गैस प्रवाहित करने पर सर्वप्रथम अविलेय बेरियम सल्फाइट (BasO3) का श्वेत अवक्षेप बनता है।
Ba(OH)2 + SO2 → BaSO3 + H2O
विलयन में अधिक देर तक SO2 प्रवाहित करने पर विलेय बेरियम बाइसल्फाइट प्राप्त होता है।
BaSO3 + H2O + SO2 → Ba(HSO3)2
(iv) कार्बोनेट लवण से अभिक्रिया : चूँकि सल्फ्यूरस अम्ल कार्बोनिक अम्ल की अपेक्षा अधिक शक्तिशाली होता है, इसलिए कार्बोनेट लवण के विलयन में SO2 गैस प्रवाहित करने पर CO2 गैस मुक्त होती है और सल्फाइट लवण बनता है।
Na2CO3 + SO2 → Na2SO3 + CO2
(v) ऑक्सीजन से अभिक्रिया : प्लैटिनम उत्प्रेरक की उपस्थिति में उसे ऑक्सीजन के साथ गर्म करने पर सल्फर ट्राइऑक्साइड बनता है।
2SO2 + O2 → 2SO3
(vi) क्लोरीन से अभिक्रिया : प्रकाश की उपस्थिति में SO2 क्लोरीन के साथ अभिक्रिया कर सल्फ्यूरिक क्लोराइड बनाता है।
SO2 + Cl2 + SO2Cl2
(vii) ऑक्सीकारक गुण : (a) सल्फर डाइऑक्साइड के जलीय विलयन में H2S गैस प्रवाहित करने पर गंधक अवक्षेपित होता है।
(b) उच्च ताप तक तप्त कार्बन के ऊपर SO2 गैस प्रवाहित करने पर CO एवं CO2 बनते हैं। यहाँ कार्बन CO एवं CO2 में ऑक्सीकृत होता है।
3C + 2SO2 → 2CO+ CO2 + 2S
(c) सान्द्र HCl में बने स्टैनस क्लोराइड को घोल से SO2 गैस प्रवाहित करने पर स्टैनस क्लोराइड स्टैनिक क्लोराइड में ऑक्सीकृत होता है।
6SnCl2 + 8HCl + 2SO2 → SnS2 + 5nCl4 + 4H2O
(d) यह कई धातुओं के ऑक्साइड को सल्फेट में ऑक्सीकृत करता है। यह PbO2 को PbSO4 में MnO2 को MnSO4 में Na2O2 को Na2SO4 में ऑक्सीकृत करता है
PbO2 + SO2 → PbSO4
MnO2 + SO2 → MnSO4
Na2O2 + SO2 →Na2SO4
(viii) अवकारक गुण : जल से यह नवजात हाइड्रोजन विस्थापित करता है, इसलिए यह अवकारक के ऐसा व्यवहार करता है।
2H2O + SO2 → H2SO4 + 2H
(a) जल की उपस्थिति में यह हैलोजन की हाइड्रा अम्लों में अवकृत करता है।
2H2O + SO2 + X2 → H2SO4 + 2Hx (X = Cl, Br, I)
(b) यह फेरिक लवणों को फेरस लवण में अवकृत करता है। जैसे-यह फेरिक क्लोराइड को फेरस क्लोराइड में अवकृत करता है।
2FeCl3 + 2H2O + SO2 → 2FeCl2 + H2SO4 + HCl
फेरिक सल्फेट को फेरस सल्फेट में अवकृत करता है।
Fe2(SO4)3 + 2H2O + SO2 → 2FeSO4 + 2H2SO4
(c) सान्द्र HCl की उपस्थिति में यह क्यूप्रिक क्लोराइड को क्युप्रस क्लोराइड में अवकृत करता है।
2CuCl2 + 2H2O+ SO2 →Cu2Cl2 + H2SO4 + 2HCl
(d) आयोडिक अम्ल और पोटैशियम आयोडेट को यह आयोडीन में अवकृत करता है।
2HIO3 + 4H2O + 5SO2 → 5H2SO4 + I2
2KIO3 + 4H2O + 5SO2 → 2KHSO4 + 3H2SO4 + I2
(e) यह अम्लीय विलयन में KMnO4 को मैग्नस सल्फेट में अवकृत करता है।
![]()
(f) सल्फ्यूरिक अम्ल की उपस्थिति में यह पोटैशियम डाइक्रोमेट को क्रोमिक सल्फेट में अवकृत करता है।
K2Cr2O7 + H2SO4 + 3SO2 → K2SO4 + Cr2 (SO4)3 + H2O
SO2 के उपयोग : इसका मुख्य उपयोग सल्फ्यूरिक अम्ल के उत्पादन में होता है। सल्फाइट एवं बाइसल्फाइट लवणों के उत्पादन में इसका उपयोग होता है। रेशम, ऊन आदि के विरंजन में इसका उपयोग होता है। इसका उपयोग चीनी उद्योग में, जीवाणुओं के नियंत्रण करने में, रेफ्जिरेशन में, प्रतिकलोर के रूप में होता है।
प्रश्न 6.
पोटैशियम डाइक्रोमेट कैसे बनाया जाता है ? इसके गुणों एवं उपयोगों का वर्णन करें।
उत्तर:
बड़े पैमाने पर इसे क्रोमाइट अयस्क (FeCr2O4) से प्राप्त किया जाता है। क्रोमाइट को पोटैशियम कार्बोनेट एवं चूना के साथ संगलित करने पर पाटैशियम क्रोमेट बनता है।
4FeCr2O4 +8K2CO3 + 8CaO + 7O2 → 8K2CrO4 + 2Fe2O3 + 8CaCO3
संगलित पदार्थ को जल से निष्कर्षित किया जाता जिससे जल में विलेय पोटैशियम क्रोमेट (K2CrO4) विलयन में चला जाता है। इसे छान कर छनित की अभिक्रिया सान्द्र सल्फ्यूरिक अम्ल से कराने पर पोटैशियम डाइक्रोमेट (K2Cr2O7) बनता है।
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
कम विलेय K2SO4 अवक्षेप के रूप में प्राप्त होता है जिसे छानकर अलग कर लिया जाता है। छीनत का सान्द्रण करने पर पोटैशियम डाइक्रोमेट के नारंगी-लाल रंग के रवे प्राप्त होते हैं।
गुण : K2Cr2O7 को गर्म करने पर अपघटित होकर ऑक्सीजन मुक्त करता है।
4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3O2
क्षार से अभिक्रिया कराने पर यह पोटैशियम क्रोमेट में बदल जाता है।
2K2Cr2O7 + 2KOH → 2K2CrO4 + H2O
K2Cr2O7 को जब किसी घुलनशील क्लोराइड जैसे NaCl एवं सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म किया जाता है तो क्रोमाइल क्लोराइड बनता है।
K2Cr2O7 + 4NaCl + 6H2SO4 → 2KHSO4 + 4NaHSO4 + 2CrO2Cl2 + 3H2O
यह HCl अम्ल के नाम अभिक्रिया कर क्लोरीन मुक्त करता है।
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 7H2O + 3Cl2
ऑक्सीकारक गुण : यह एक प्रबल ऑक्सीकारक है। अम्लीय माध्यम में यह आसानी से अवकारक से इलेक्ट्रॉन ग्रहण कर Cr3+ में अवकृत हो जाता है। यहाँ क्रोमियम +6 अवस्था से +3 अवस्था में अवकृत होता है।
\(\mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}\) + 14H+ +6e– → 2Cr3 + 7H2O
अम्लीय माध्यम तनु H2SO4 के द्वारा बनाया जाता है क्योंकि यह ऑक्सीकारक या अवकारक के ऐसा कार्य नहीं करता है। HCl या HNO3 का उपयोग अम्लीय माध्यम बनाने में नहीं किया जाता है क्योंकि ये स्वयं K2Cr2O7 से अभिक्रिया करते हैं।
अम्लीय माध्यम में यह आयोडाइड लवण से आयोडीन मुक्त करता है।
K2Cr2O7 + 7H2SO4 +6KI → 4K2SO4 + Cr(SO4)3 + 7H2O + 3l2
(\(\mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}\) + 14H+ +6I– → 2Cr3+ + 7H2O + 3I2)
अम्लीय माध्यम में यह फेरस लवण को फेरिक लवण, सल्फाइट को सल्फेट, H2S को H2SO2 में ऑक्सीकृत करता है।
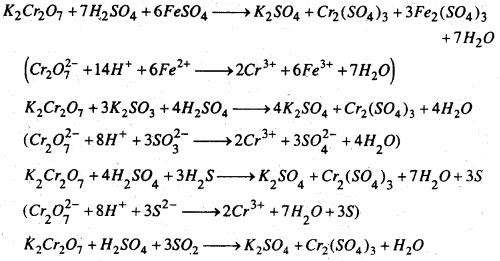
(Cr2\(O_{7}^{2-}\) + 2H+ + 3SO2 → 2Cr3+ + H2O + 3S\(O_{7}^{2-}\))
उपयोग : प्रयोगशाला में इसका उपयोग आयतनीय विश्लेषण में किया जाता है। क्रोमियम के दूसरे यौगिकों जैसे क्रोम रेड, जिंक इलो, क्रोम इलो आदि के बनाने में किया जाता है जिसका उपयोग पिगमेण्ट के रूप में किया जाता है। इसका उपयोग रंगाई उद्योग, क्रोम टैनिंग, फैलिकोप्रिटिंग में किया जाता है।
प्रश्न 7.
निम्नलिखित संदर्भ में प्रथम संक्रमण श्रेणी (First transition series) के तत्त्वों के गुणों का वर्णन करें-धातुई गुण (metallic character), आयनन ऊर्जा, ऑक्सीकरण अवस्था, रंग, उत्प्रेरकीय गुण, चुम्बकीय गुण, अंतराली यौगिक, मिश्र धातु का निर्माण।
उत्तर:
आवर्त सारणी के चौथे आवर्त में Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu और Zn प्रथम संक्रमण श्रेणी के तत्त्व हैं। इनके 3d सबशेल में इलेक्ट्रॉन क्रमशः प्रवेश करते हैं।
इनका इलेक्ट्रॉनिक विन्यास निम्न प्रकार हैं-
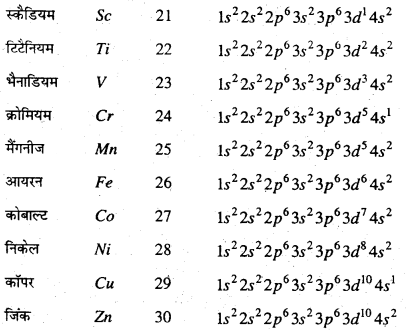
(i) धातुई गुण : ये सभी तत्त्व धातु हैं। ये ऊष्मा एवं विद्युत के सुचालक होते हैं। वर्ग 8, 9, 10 और 11 का संक्रमण धातुएँ अन्य धातुओं की तुलना में अधिक मुलायम और तन्य होती हैं।
(ii) आयनन ऊर्जा : इनके आयनन ऊर्जा के मान में बहत कम परिवर्तन होता है। इनके आयनन ऊर्जा s और p ब्लॉक के तत्त्वों के मध्यवर्ती होता है। अतः ये तत्त्व वर्ग 1 और 2 के तत्त्वों की अपेक्षा कम विद्युत धनात्मक होते हैं। इनके आयनन ऊर्जा में वृद्धि या कमी में कोई निरंतरता नहीं है।
(iii) ऑक्सीकरण अवस्था : सभी धातुएँ एक से अधिक ऑक्सीकरण अवस्थाएँ प्रदर्शित करती हैं। इसका कारण है कि (n – 1)d और ns ऑर्बिटलों की ऊर्जा में अधिक अन्तर नहीं होता है। इसलिए ये तत्त्व बंधन के निर्माण में ns के साथ-साथ (n – 1)d इलेक्ट्रॉन का भी प्रयोग करते हैं। Sc और Cu को छोड़कर +2 ऑक्सीकरण अवस्था स्थायी अवस्था है। Cu + I अवस्था में भी यौगिक का निर्माण करता है। Mn, Ni, Cu एवं Zn के अलावे सभी तत्त्वों के लिए +3 ऑक्सीकरण अवस्था स्थायी अवस्था है। Ti, V, Mn के लिए +4 ऑक्सीकरण अवस्था भी स्थायी होता है। V के लिए +5 और Mn के लिए +7 ऑक्सीकरण अवस्था भी स्थायी होता है। Sc से Mn तक उच्च ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति बढ़ती है और इसके बाद पुनः घटने लगती है।
(iv) रंग : इनके अधिकांश यौगिक रंगीन होते हैं। इनके यौगिकों के रंगीन होने का कारण d-सबशेल में इलेक्ट्रॉन का संक्रमण है। d-सबशेल के इलेक्ट्रॉन ऊर्जा ग्रहण कर उसी सबशेल में उच्च ऊर्जा स्तर में जाते हैं। इसमें प्रकाश ऊर्जा का अवशोषण दृश्य क्षेत्र में होता है। अतः यौगिक रंगीन दिखता है।

अतः did संक्रमण के कारण यौगिक रंगीन दिखता है।
इनके यौगिक आवेश स्थानान्तरणं के कारण भी रंगीन दीखते हैं। जिन आयनों में d-सबशेलं रिक्त या पूर्णतः भरे होते हैं, वे रंगहीन होते हैं। जैसे-Sc3+, Ti4+, Cu+, Zn2+।
(v) उन्प्रेग्काय गुण : इनमें कई तत्त्व एवं उनके यौगिक उत्प्रेरक का कार्य करते हैं। Fe, Ni, V आदि धातुओं एवं इनके यौगिकों जैसे V2O5 का उपयोग उत्प्रेरक के रूप में किया जाता है। चूंकि संक्रमण तत्त्व की संयोजकता एक से अधिक होती है इसलिए ये आसानी से प्रतिफल के साथ मध्यवर्ती यौगिक का निर्माण करते हैं जो आसानी से विघटित होकर प्रतिफल देते हैं। इसलिए ये उत्प्रेरक का कार्य करते हैं।
(vi) चुम्बकीय गुण : अधिकांश संक्रमण तत्त्वों में अयुग्मित इलेक्ट्रॉन होते हैं इसलिए ये अनुचुंबकीय होते हैं। अयुग्मित इलेक्ट्रॉनों की संख्या जितनी अधिक होती है, अनुचुंबकत्व भी उतना ही अधिक होता है। Sc3+ एवं Zn2+ में अयुग्मित इलेक्ट्रॉन नहीं होते हैं इसलिए ये प्रतिचुंबकीय होते हैं। द्विसंयोजी आयन (M2+) का चुंबकीय आघूर्ण Ti2+ से Mn2+ तक बढ़ता है और उसके बाद घटते हुए Zn2+ तक शून्य हो जाता है। ऐसा इसलिए होता है कि M2+ आयन अयुग्मित इलेक्ट्रॉनों की संख्या Ti2+ (d2) से Mn2+ (d5) तक बढ़ती है और फिर उसके बाद घटने लगती है और Zn2+ में शून्य हो जाती है। Fe, Co एवं Ni फेरोचुंबकीय होते हैं क्योंकि ये चुंबक बनाये जा सकते हैं।
(vii) अंतराली यौगिक (Interstitial compound) : d-ब्लॉक के संक्रमण तत्त्वों के जालक में रिक्त स्थान होते हैं। इन रिक्त स्थानों में ये धातु छोटे आकारवाले परमाणुओं जैसे H, B,C और N को ग्रहण करके उनके साथ बंधन भी बना लेते हैं। ऐसे बंधनयुक्त यौगिक अंतराली यौगिक कहलाते हैं। ये non-stoichiometric compound होते हैं और इनका कोई निश्चित सूत्र नहीं होता है।
(viii) मिश्रधातु का निर्माण : d-ब्लॉक की संक्रमण धातुएँ अन्य तत्त्वों के साथ संयोग करके आसानी से मिश्रधातुओं का निर्माण करती है। इसका कारण यह है कि इन धातुओं के परमाणु आकार में काफी समानता होती है, इसलिए इनके परमाणु एक-दूसरे के साथ मिश्रित होकर मिश्रधातु बनाते हैं। उदाहरण के लिए क्रोम इस्पात, वैनेडियम इस्पात, मैगनीज इस्पात, स्टेनलेस स्टील ऐसी ही मिश्रधातुएँ हैं।
प्रश्न 8.
एमीनो एसिड क्या है ? Essential एवं nonessential amino acid को उदाहरण महित समझावें।
उत्तर:
वैसा कार्बनिक यौगिक जिसमें कार्बोक्सिलिक और एमीनों मूलक दोनों होते हैं, एमीनो अम्ल कहलाते हैं। जब -COOH और -NH2 दोनों ही मूलक एक ही कार्बन परमाणु से जुड़े होते हैं तो उसे -एमीनो अम्ल कहते हैं। उदाहरणार्थ, ग्लाइसीन NH2 · CH2 · COOH (α-एमीनो अम्ल)।
α-एमीनो अम्लों की आवश्यकता पेप्टाइड एवं प्रोटीन के संश्लेषण में होता है। पेड़-पौधों एवं जानवरों में पाये जाने वाले प्रोटीन में 20 α-एमीनो अम्ल होते हैं।
हमारा शरीर सभी 20 एमीनो अम्लों को बनाने में सक्षम नहीं है जिसकी आवश्यकता विभिन्न प्रोटीनों के निर्माण के लिए आवश्यक है। इन 20 एमीनो अम्लों में 10 एमीनो अम्लों का निर्माण हमारा शरीर करता है। अतः इन 10 एमीनो अम्लों को nonessential एमीनो अम्ल कहते हैं। दूसरे शब्दों में जिन 10 एमीनों अम्लों का निर्माण करने में हमारा शरीर सक्षम है, उसे nonessential एमीनोअम्ल कहते हैं। उदाहरणार्थ, ग्लाइसीन, cysteine इत्यादि।
जिन 10 एमीनों अम्लों का उत्पादन करने में हमारा शरीर सक्षम नहीं है उन्हें essential एमीनो अम्ले कहते हैं उदाहरणार्थ, लयुसीन, फिनाइल एलानीन, लाइसीन इत्यादि essential एमीनो अम्ल हैं।
प्रश्न 9.
विटामिन क्या है ? इनका वर्गीकरण कैसे किया जाता है ? रक्त के स्कन्दन के लिए कौन विटामिन जिम्मेदार है?
उत्तर:
विटामिन कार्बनिक यौगिक है जिनकी थोड़ी मात्रा की आवश्यकता भोजन में होती है। ये विशिष्ट जैविक कार्य करते हैं जो organism के स्वस्थ रहने और उनके वृद्धि में सहायक होते हैं। विटामिन को अंग्रेजी वर्णमाला के A, B, C, D आदि से व्यक्त किया जाता है। कुछ विटामिन को उप वर्गों B1, B2, B6, B12 के रूप में नामकरण किया जाता है।
जल या वसा में विलेयता के आधार पर विटामिन को दो वर्गों में बाँटा गया है-
(a) वसा में विलेय विटामिन : इस वर्ग में वैसे विटामिन को रखा गया है जो तेल वसा में विलेय होते हैं। विटामिन A, D, E एवं k इस श्रेणी में आते हैं। ये लीवर और adipose tissues में जमा रहते हैं।
(b) जल में विलेय विटामिन : इस श्रेणी में वैसे विटामिन को रखा गया है जो जल विलेय होते हैं। विटामिन B और C इस श्रेणी के अन्तर्गत आते हैं। ये विटामिन हमारे शरीर में संग्रहीत नहीं रहते हैं। इन्हें हमेशा लेते रहने की आवश्यकता होती है।
प्रश्न 10.
निम्न के दो-दो उदाहरण दें
(i) antipyretics (ii) analgesics (iii) transquilizers (iv) antiseptic (v) disinfectant (ví) antimicrobials (vii) antifertility drugs (viii) antibiotic.
उत्तर:
(i) Antipyretics : वे रासायनिक पदार्थ जो बुखार के समय शरीर के ताप को घटाते हैं, antipyretic कहलाते हैं। उदाहरण-नोभालजिन, परासिटामोल, एस्प्रीन।
(ii) Analgesic : वह रासायनिक पदार्थ जो दर्द को दूर करता है, analgesic कहलाता है। उदाहरण-मॉरफिन, नोभालजिन, एस्प्रीन।
(iii) Tranquilizer : वे पदार्थ जो central nervous system को प्रभावित करते हैं और मानसिक रोगों को दूर करते हैं, tranquilizer कहलाते हैं। उदाहरण-Reserpine, luminal, seconal.
(iv) Antiseptic : वे रासायनिक पदार्थ जो जीवित मानव tissues को हानि नहीं पहुंचाते हैं लेकिन micro organism को बढ़ने से रोकते हैं या मार देते हैं, antiseptic कहलाते हैं।
उदाहरण : बोरिक अम्ल, मरक्युरिक क्लोराइड, टिंक्चर ऑफ आयोडीन, डेटॉल, 0.2% फेनॉल।
(v) Disinfectant : वे रासायनिक पदार्थ जो micro organism को बढ़ने से रोकते हैं या मार देते हैं लेकिन मानव tissues या skin के लिए हानिकारक होते हैं, disinfectant कहलाते हैं। उदाहरण-1% फेनॉल; 0.2 से 0.4 ppm क्लोरीन।
(vi) Antimicrobial : वे रासायनिक पदार्थ जो शरीर के अन्दर की बैक्टीरिया को बढ़ने से रोकता है या मार डालता है तथा शरीर के प्रतिरोधक क्षमता को बढ़ाता है antimicrobial कहलाते हैं।
उदाहरण : Salvarsan, prontosil
(vii) Antifertility drug : वे रासायनिक पदार्थ जो प्रजनन को नियंत्रित करने के लिए काम में लाया जाता है, antifertility drug कहलाते हैं। उदाहरण-Progesterone, ethynylestrodiol
(viii) Antibiotics : कुछ खास micro-organisms (फंजाई, बैक्टिरीया, moulds) द्वारा निर्मित पदार्थ जो micro-organisms के metabolic क्रिया में प्रवेश कर उनकी वृद्धि को रोकते हैं या उन्हें मार देते हैं, antibiotics कहलाते हैं। प्रथम आविष्कृत antibiotic पेनिसिलीन है जो अलक्जेंडर फलेमिंग के द्वारा 1929 में खोजा गया था। इसके उदाहरण हैं-क्लोराम फेनिकॉल, टेट्रासाइक्लिन, स्ट्रेप्टोमाइसिन ओफ्लोक्सासीन आदि। .
प्रश्न 11.
What do you mean by abnormal molecular weight ? Explain the reason of this abnormality. Calculate the degree of dissociation of a substance with the help of abnormal molecular weight.
(असामान्य अणुभार से आप क्या समझते हैं ? इस असामान्यता का कारण स्पष्ट करें। असामान्य अणुभार की सहायता से पदार्थ के विघटांश की गणना करें।)
उत्तर:
असामान्य अणुभार : कुछ पदार्थ, मुख्यतः विद्युत-विच्छेद के अणुभार का हिमांक विधि से प्राप्त मान तथा सूत्र \(\left[m=k_{t} \frac{w \times 1000}{\Delta T_{f} \times w}\right]\) द्वारा गणित मान से काफी भिन्न होता है। अणुभार का प्रायोगिक मान सूत्र द्वारा गणित मान से कभी बहुत कम या कभी बहुत अधिक होता है। इस प्रायोगिक अणुभार को असामान्य अणुभार कहते हैं।
असामान्यता का कारण (Reason of abnormality) : पदार्थों का अणुभार की असामान्यता का कारण घोल में घुल्य के अणुओं का विघटन (जैसे-NaCl, K2SO2, BaCl2 आदि का जल में अथवा संगुणन (जैसे-ऐसीटिक अम्ल, बेंजोइक अम्ल बेंजीन में) होता है। विघटन या संगुणन के कारण घोल में घुल्य के कणों (अणुओं का आयनों) की संख्या सामान्य संख्या से अधिक या कम हो जाती है। यह ज्ञात है कि घोल का सहजात गुण (colligative properties) घोल में उपस्थित घुल्य की संख्या पर निर्भर करता है, उनके स्वभाव पर नहीं अतः हिमांक का अवनमन जो घोल का सहजात गुण है, घोल में उपस्थित घुल्य के कणों की संख्या पर निर्भर करता है; उनके स्वभाव पर नहीं अर्थात्
हिमांक का अवनमन [ΔTf] ∝ घोल में वर्तमान घुल्य के कणों की संख्या।
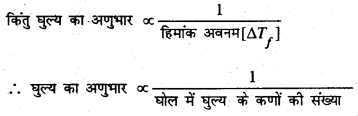
अतएव विघटन की अवस्था में घोल में घुल्य के कणों की संख्या बढ़ जाती है, जिससे अणुभार कम जाता है तथा संगुणन की अवस्था में घोल में घुल्य के कणों की संख्या कम जाती है जिससे अणुभार बढ़ जाता है।
विघटनांश की गणना : जो पदार्थ घोल में विघटित या आयनित होते हैं, उन्हें विद्युत-विच्छेद कहते हैं। इनके विघटनांश की गणना निम्नांकित प्रकार से की जाती है-
माना कि किसी पदार्थ AB को जल में घोलने पर इसका विघटन निम्न प्रकार होता है-
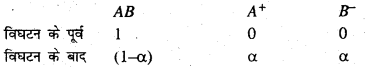
माना कि पदार्थ AB का 1 ग्राम अणु लिया गया है तथा इसका विघटनांश α है। उपरोक्त समीकरण से स्पष्ट है कि AB के a ग्राम-अणु विघटित होने से α ग्राम-अणु A+ आयन एवं α ग्राम-अणु B– आयन प्राप्त होते हैं। तथा AB का [1 – α] ग्राम-अणु अविघटित बचा रहता है।
अतः विघटन के पूर्व कणों की संख्या = 1
तथा विघटन के बाद कणों की संख्या = 1 – α + α + α = 1 + α

यदि किसी घुल्य का एक अणु विघटित होकर दो आयन के बदलें n आयन देता हो, तब
α = \(\frac{M_{T}-M_{E}}{M_{E}[n-1]}\)