BSEB Bihar Board 12th Chemistry Important Questions Long Answer Type Part 2 are the best resource for students which helps in revision.
Bihar Board 12th Chemistry Important Questions Long Answer Type Part 2
प्रश्न 1.
Write short notes on the following
(निम्नलिखित पर संक्षिप्त टिप्पणी लिखें-)
(1) Lyophilic and Lyophobic colloids (2) Tyndall effect (3) Brownian Movement (4) Electrophoresis.
उत्तर:
(1) Lyophilic Colloids : वे पदार्थ जो dispersion medium के सम्पर्क में आने पर सुगमता से disperesed होकर colloidal solution बना लेता है, Lyophiilic colloids कहलाते हैं।
यदि dispersion medium जल हो तो प्राप्त colloidal solution जल-स्नेही कहा जायेगा अन्यथा द्रव-स्नेही। For example : Protein, Starch, Rubber, Gum, Galatine etc. द्रव-स्नेही होते हैं। द्रव-स्नेही colloidal का घोल स्थायी होता है। इसका वाष्पण कर अवशिष्ट पदार्थ को यदि घोल में मिश्रित कर दिया जाय तो पुनः colloidal solution प्राप्त हो सकता है। अतः इन्हें reversible colloidal भी कहते हैं।
(1) Lyophobic Colloids : वे पदार्थ जो dispersion medium के सम्पर्क में आने पर सुगमता से disperesed होकर colloidal solution बना लेता है, Lyophillic colloids कहलाते हैं।
For example : Arseni sulphite, Ferric hydroxide, Gold fci Lyophobic colloidal solution कम स्थायी होते हैं। इन्हें वाष्पित कर अवशिष्ट पदार्थ को dispersion medium में डालने से पुनः colloidal state में नहीं लाया जा सकता है। अतः इन्हें Irreversible colloids कहते हैं।
(2) Tindall effect : सन् 1869 ई० में Tyndall ने पाया कि किसी प्रकाशपुंज को एक True solution से होकर प्रवाहित करने पर इसे तब तक देखा नहीं जा सकता जबतक कि आँख को सीधे उसके मार्ग में न रखा जाए किन्तु उसी प्रकाशपुंज को एक colloidal solution से होकर प्रवाहित करने पर किरण-पथ प्रभासित हो जाता है। इस घटना को Tyndall effect कहते हैं।
इसी प्रकार की घटना उस समय भी देखी जाती है जब कोई प्रकाशपुंज एक छेद से होकर अंधेरे कमरे में प्रवेश करता है। कमरे में वर्तमान धूल के कण जो पहले तो अदृश्य थे, scattering of light से स्पष्ट दिखाई पड़ने लगते हैं।
जब तीव्र प्रकाशपुंज को colloidal solution में से प्रवाहित किया जाता है तो परिक्षिप्त अवस्था (dispersed phase) में कण प्रकाशपुंज को scatter करके अपने चारों ओर बिखेर देते हैं। Scattering of light के कारण colloidal particle प्रकाश ऊर्जा का अधिशोषण करके स्वयं चमकने लगते हैं, जिससे किरण-पथ प्रभासित हो जाता है। चूंकि प्रकाशपुंज की अधिकतम तीव्रता किरण पथ के समकोण पर होती है अतः किरण पथ को समकोण दिशा से देखने पर मार्ग दृष्टिगोचर हो जाता है। इस प्रभाव को सर्वप्रथम Faraday ने देखा किन्तु इसका विस्तृत अध्ययन Tyndall ने किया। अतः इस प्रभाव को Tyndall effect कहते हैं। इस प्रभाव द्वारा colloidal solution तथा True solution में विभेद किया जा सकता है। यह प्रभाव colloidal solution में कणों की संख्या ज्ञात करने में लाभदायक है।
(3) Brownian movement : सन् 1827 ई० में अंग्रेज Botanical Scientist Robert Brown ने अति सूक्ष्मदर्शी की सहायता से पानी में अविलम्बित पोलन के कणों के अध्ययन के फलस्वरूप पाया कि ये कण हमेशा अनियमित रूप से गतिमान रहते हैं। इसकी गमन की दिशा तेजी से बदलती रहती है। Collidal particle में भी इसी प्रकार की गति पायी जाती है। कणों में वर्तमान इस प्रकार की गति को उसके आविष्कारक के नाम पर Brownian movement कहते हैं। यह गति colloidal particle में प्रकृति नहीं पर निर्भर करती है।

कण जितने ही सूक्ष्म होते हैं तथा माध्यम की visocity जितनी ही कम होती है यह, गति उतनी ही तेज होती है।
Brownian movement उत्पन्न होने का कारण यह है कि collidal particle पर परिक्षेपण के माध्यम के अणुओं द्वारा असमान टक्करें होती हैं, फलतः ये colloidal particle परिक्षेपण माध्यम के अणुओं की अपेक्षा काफी भारी होता है। अतः उनकी गति माध्यम के अणुओं से कम होती रहती है।
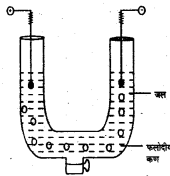
(4) Electrophoresis : Colloidal solution के कणों या +ve या -ve आवेश उपस्थित रहते हैं। अतः इस घोल से होकर Electric current प्रवाहित करने पर ये कण विपरीत आवेश वाले Electrode की ओर गमन करने लगते हैं।
Electrode पर पहुंचकर ये आवेशहीन हो जाते हैं तथा अवक्षेप के रूप में पृथक् हो जाते हैं। विद्युत में colloidal particle को Electrophoresis कहते हैं।
For example : AS2S3 (Arsenic sulphide) जिस पर -ve charge रहता है, के colloidal solution को एक U आकार के नली में लेकर electric current प्रवाहित करने पर collidal particle anode की ओर आकर्षित होते हैं।
इसके विपरीत positive charge युक्त colloidal solution [जैसे-Fe(OH)3 का घोल] U आकार की नली में लेकर electric current प्रवाहित करने पर colloidal particle cathode की ओर आकर्षित होते हैं।
इस विधि द्वारा colloidal particle पर उपस्थित आवेश की पहचान की जा सकती है। इसके अतिरिक्त इसमें कणों की गति भी ज्ञात की जा सकती है।
प्रश्न 2.
What do you mean by rate of reaction ? What is its unit ? What are the factors affecting the rate of reaction ?
(प्रतिक्रिया के वेग से आप क्या समझते हैं ? इसका मात्रक क्या है, प्रतिक्रिया के वेग को प्रभावित करने वाले कौन से कारक हैं ?)
उत्तर:
प्रतिक्रिया का वेग (Rate of reaction) : रासायनिक प्रतिक्रियाएँ प्रतिकारकों के अणुओं के बीच टकराव से होती है। टकराव के कारण पुराने बन्धन (bond) टूटते हैं तथा नये
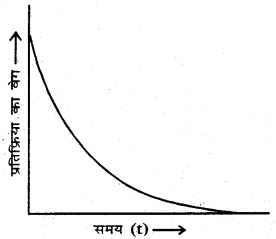
बन्धनों का निर्माण होता है। प्रतिक्रिया प्रारम्भ हो जाने पर प्रतिकारकों की सान्द्रता घटने लगती है तथा प्रतिफल की सान्द्रता बढ़ने लगती है। चूंकि प्रतिक्रिया का वेग प्रतिकारकों की सान्द्रता पर निर्भर करता है। अत: प्रतिक्रिया का वेग प्रतिक्रिया के प्रारम्भ में तेज होता है किन्तु जैसे-जैसे समय बीतता जाता है वैसे-वैसे प्रतिक्रिया का वेग भी घटता जाता है। प्रतिक्रिया के वेग तथा समय के बीच graph खींचने पर प्राप्त लेखाचित्र से भी इस तथ्य की पुष्टि होती है।
इकाई समय में प्रतिकारकों या प्रतिफलों की सान्द्रता में हुए परिवर्तन की प्रतिक्रिया को गति की दर कहते हैं। किसी प्रतिक्रिया की गति प्रतिकारकों की सान्द्रता पर निर्भर करती है। “अतः किसी प्रतिक्रिया में प्रतिकारकों की सान्द्रता के घटने की दर अथवा प्रतिफलों की सान्द्रता के बढ़ने की दर को प्रतिक्रिया का वेग कहते हैं।”
यदि प्रतिक्रिया के किसी क्षण में प्रतिकारक का सान्द्रण ‘C’ है तो उस समय प्रतिक्रिया का वेग \(\left(\frac{d x}{d t}\right)\) सान्द्रण (C) का समानुपाती होता है। अर्थात्
\(\frac{d x}{d t}\) ∝ C
या, \(\frac{d x}{d t}\) = K ·C
जहाँ K एक स्थिरांक है, जिसे वेग स्थिरांक (Rate constant) कहते हैं।
प्रतिक्रिया का वेग निम्न प्रकार लिखा जाता है-
प्रतिक्रिया A → B के लिए
प्रतिक्रिया का वेग = \(-\frac{d[A]}{d t}=+\frac{d[B]}{d t}\)
समय के साथ A का सान्द्रण घटता है। अतः इसके लिए ऋण-चिह्न दिया जाता है तथा समय के साथ B का सान्द्रण बढ़ता है, इसके लिए धन चिह्न दिया जाता है।
प्रतिक्रिया के वेग का मात्रक (Unit) :
![]()

अतः प्रतिक्रिया के वेग को मोल प्रति लीटर प्रति सेकेण्ड में व्यक्त किया जाता है।
प्रतिक्रिया के वेग को प्रभावित करने वाले कारक :
प्रतिक्रिया के वेग को प्रभावित करने वाले निम्नलिखित कारक हैं-
(i) प्रतिकारकों की सान्द्रता (Concentration of reactants) : प्रतिकारकों की सान्द्रता प्रतिक्रिया के वेग को प्रभावित करती है। प्रतिकारकों की सान्द्रता बढ़ाने से प्रतिक्रिया का वेग बढ़ता है तथा घटाने से घटता है।
(ii) तापमान (Temperature) : प्रतिक्रिया का वेग बढ़ाने से प्रतिक्रिया का वेग सामान्यतः बढ़ता है। मोटे तौर पर 10°C तापमान बढ़ाने से प्रतिक्रिया का वेग दुगुना हो जाता है।
(iii) प्रतिकारकों की प्रकृति (Nature of reactants) : प्रतिक्रिया के वेग पर प्रतिकारकों की प्रकृति का काफी प्रभाव पड़ता है। जैसे-Sodium धातु साधारण ताप पर ही जल से प्रतिक्रिया करती है जबकि Mg धातु उबलते हुए जल के साथ प्रतिक्रिया करती है।
(iv) उत्प्रेरक (Catalyst) : प्रतिक्रिया के वेग पर उत्प्रेरक का प्रभाव पड़ता है। उत्प्रेरक की उपस्थिति से प्रतिक्रिया का वेग बढ़ता अथवा घटता है। जैसे-शुद्ध एवं शुष्क H2 तथा O2 परस्पर संयोग नहीं करता है किन्तु जलवाष्प की अल्प मात्रा की उपस्थिति से दोनों शीघ्रता से संयोग करके H2O बनाते हैं। इसी प्रकार H2O2 में थोड़ा glycerol मिला देने पर H2O2 का विघटन कम हो जाता है।
(v) प्रतिकारकों का पृष्ठ-तल (Surface area of reactants) : प्रतिकारकों का आकार जैसे-जैसे छोटा किया जाता है, उनका surface area बढ़ते जाता है; फलस्वरूप प्रतिक्रिया का वेग र भी बढ़ते जाता है।
प्रश्न 3.
Define the following : (1) Conductivity (2) Specific conductivity (3) Equivalent conductivity and (4) Molecular conductivity.
(निम्नांकित की परिभाषा लिखें-
(1) चालकता (2) विशिष्ट चालकता (3) तुल्यांकी चालकता तथा (4) आण्विक चालकता।)
उत्तर:
(A) (1) चालकता (Conductivity) : किसी चालक से होकर विद्युत धारा जिस सुगमता से प्रवाहित होती है, उसे उसकी चालकता कहते हैं। चालक की चालकता उसके प्रतिरोध का व्युत्क्रम होता है। अर्थात्
![]()
(2) विशिष्ट चालकता (Specific Conductivity) : विशिष्ट प्रतिरोध के व्युत्क्रम को विशिष्ट चालकता कहते हैं। इसे प्रायः K (kappa) द्वारा व्यक्त किया जाता है। अर्थात्
K = \(\frac{1}{\rho}\),
जहा ρ = विशिष्ट प्रतिरोध।
दूसरे रूप में इसे निम्नांकित प्रकार परिभाषित कर सकते हैं-
हम जानते हैं कि-
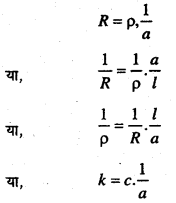
यदि l = 1 से० मी० तथा a = 1 वर्ग से० मी० हो तो
k = c
अतः “चालकता के एक से० मी० घन की चालकता को विशिष्ट चालकता कहते हैं।”
किसी विद्युत अपघट्य के जलीय घोल की विशिष्ट चालकता : “घोल के एक से० मी० घन की चालकता को विशिष्ट चालकता कहते हैं।”
(3) तुल्यांकी चालकता (Equivalent conductivity) : “किसी घोल के विशिष्ट चालकता तथा घोल का आयतन घन से० मी० (जिसमें विद्युत अपघट्य का एक ग्राम तुल्यांक घुला हुआ हो; के गुणनफल को तुल्यांकी चालकता कहते हैं।” इसे λ द्वारा सूचित किया जाता है। अतः तुल्यांकी चालकता = विशिष्ट चालकता × घोल का आयतन घन से० मी० में।
या dλv = kν × V
(4) आण्विक चालकता (Molecular conductivity) : “किसी घोल के विशिष्ट चालकता तथा घोल का आयतन धन से० मी० में (जिसमें विद्युत-अपघट्य का एक ग्राम-अणु घुला हुआ हो) के गुणनफल को आण्विक चालकता कहते हैं।” इसे द्वारा सूचित किया जाता है। अतः आण्विक चालकता = विशिष्ट चालकता × घोल का आयतन घन से० मी० में।
प्रश्न 4.
(A) State and explain Faraday’s Law of electrolysis.
(विद्युत-विच्छेदन सम्बन्धी फैराडे के नियमों को लिखें तथा वर्णन करें।)
(B) What do you mean by electro-chemical equivalent ? Establish the relation between electro chemical equivalent and chemical equivalent weight.
(विद्युत रासायनिक समतुल्यांक से आप क्या समझते हैं, विद्युत रासायनिक समतुल्यांक तथा रासायनिक समतुल्यांक भार के बीच सम्बन्ध स्थापित करें।)
उत्तर:
(A) फैराडे के विद्युत-विच्छेदन नियम : माइकेल फैराडे ने अनेक प्रयोगों के आधार पर 1932 में विद्युत विच्छेदन सम्बन्धी दो नियमों का प्रतिपादन किया, जिसे फैराडे के विद्युत-विच्छेदन नियम कहते हैं। इनके अनुसार-
प्रथम नियम :विद्युत विच्छेदन की क्रिया में प्रत्येक इलेक्ट्रोड पर मुक्त होने वाले पदार्थ की मात्रा घोल में प्रवाहित विद्युत धारा के परिमाण के समानुपाती होती है।
माना कि घोल में C ऐम्पियर की विद्युत धारा t सेकेण्ड तक प्रवाहित करने पर W ग्राम पदार्थ मुक्त होती है। विद्यत धारा का परिमाण एकूलम्ब हो तो
विद्युत धारा का परिमाण = ऐम्पियर x समय (सेकेण्ड में)
अर्थात् Q = C × t
अतः फैराडे के प्रथम नियम के अनुसार-
.: W ∝ c.t
या, W = z.c.t ………..(1)
जहाँ 2 एक स्थिरांक है जिसे “विद्युत रासायनिक समतुल्यांक” कहते हैं।
यदि c = 1 ऐम्पियर तथा t = 1 सेकेण्ड हो तो,
W = z.1.1
या W = z ……….(2)
अर्थात्, जब किसी विद्युत विच्छेद के घोल से 1 ऐम्पियर की धारा 1 सेकेण्ड तक प्रवाहित की जाती है, तो इलेक्ट्रोड पर मुक्त पदार्थ की मात्रा विद्युत रासायनिक समतुल्यांक के बराबर होती है।
द्वितीय नियम : यदि श्रेणीक्रम में जोड़े गये विभिन्न विद्युत विच्छेदन के घोलों से होकर विद्युत की समान धारा प्रवाहित की जाय तो मुक्त पदार्थों की मात्राएँ उनके रासायनिक समतुल्यांकों के समानुपाती होती हैं।
माना कि मुक्त होने वाले पदार्थों की मात्राएँ क्रमशः W1 तथा W2 ग्राम हैं तथा उनके रासायनिक समतुल्यांक क्रमशः E1 तथा E2 हैं, तो फैराडे के द्वितीय नियम के अनुसार-
W1 ∝ E1
या, W1 = KE1 ……….(1)
तथा W2 ∝ W2
या, W2 = K.E2 ………..(2)
समी० (1) में (2) से भाग देने पर,
\(\frac{W_{1}}{W_{2}}=\frac{E_{1}}{E_{2}}\) ………….(3)
फैराडे के विद्युत विच्छेदन के प्रथम नियम से हम जानते हैं कि-
W= z.c.t. यदि मुक्त पदार्थों का विद्युत रासायनिक समतुल्यांक क्रमशः Z1 तथा Z2 हों तो
W1 = Z1 c.t.
तथा W2 = Z2 c.t.
W1 तथा W2 का मान समी० (3) में रखने पर,

अर्थात, किसी पदार्थ का विद्युत् रासायनिक समतुल्यांक उसके रासायनिक समतुल्यांक भार का समानुपाती होता है।
(B) विद्युत रासायनिक समतुल्यांक : फैराडे के विद्युत विच्छेदन के प्रथम नियम से हम जानते हैं कि-
W ∝ c.t
या, W ∝ = c.c.t.
जहाँ W = इलेक्ट्रोड पर मुक्त पदार्थ की मात्रा C = ऐम्पियर में विद्युत धारा की शक्ति t = सेकेण्ड में समय तथा Z = विद्युत रासायनिक समतुल्यांक हैं।
यदि C = 1 ऐम्पियर तथा t = 1 सेकेण्ड हो तो
W = Z
अतः “एक ऐम्पियर की विद्युत धारा एक सेकेण्ड तक प्रवाहित करने पर इलेक्ट्रोड पर मुक्त पदार्थ की मात्रा उसका विद्युत रासायनिक समतुल्यांक कहलाता है।”
विद्युत रासायनिक समतुल्य तथा रासायनिक समतुल्यांक भार में सम्बन्ध :
फैराडे के द्वितीय नियम से हम जानते हैं कि-
\(\frac{W_{1}}{W_{2}}=\frac{E_{1}}{E_{2}}\)
जहाँ W1 तथा W2 क्रमशः इलेक्ट्रॉड पर मुक्त होने वाले पदार्थों की मात्राएँ (ग्राम में) और E1 तथा E2 क्रमशः उनके रासायनिक समतुल्यांक भार हैं।
फैराडे के प्रथम नियम से-W = z.c.t.
अतः W1 = z1 c.t. तथा W2 = z2 c.t.
समी0 (1) में W1 तथा W2 का मान रखने पर,
\(\frac{Z_{1} c . t .}{Z_{2} c . t .}=\frac{E_{1}}{E_{2}}\)
या, \(\frac{Z_{1}}{Z_{2}}=\frac{E_{1}}{E_{2}}\)
या, Z ∝ E
अर्थात् किसी पदार्थ का विद्युत रासायनिक समतुल्यांक उसके रासायनिक समतुल्यांक भार के समानुपाती होता है।
किसी विद्युत विच्छेदन के घोल से 1 कुलम्ब विद्युत धारा प्रवाहित करने पर मुक्त पदार्थ की मात्रा उसका विद्युत रासायनिक समतुल्यांक कहलाता है।
इसी प्रकार, किसी विद्युत विच्छेदन के घोल से 96500 कुलम्ब धारा प्रवाहित करने पर मुक्त पदार्थ की मात्रा उसका रासायनिक समतुल्यांक भार कहलाता है।
अतः रासायनिक समतुल्यांक भार = 96500 × विद्युत रासायनिक समतुल्यांक
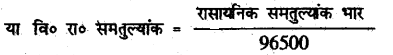
प्रश्न 5.
State and explain Kohlrausch’s law :
(Kohlrausch’s का नियम लिखें एवं समझावें।)
उत्तर:
Kohirausch’s ने विभिन्न विद्युत अपघट्यों के अनन्त तनुता पर तुल्यांकी चालकता (λ∞) के मानों का विस्तृत अध्ययन किया और पाया कि λ∞ में प्रत्येक आयन का स्वतंत्र रूप से एक निश्चित योगदान होता है। अपने प्रक्षणों के आधार पर उन्होंने एक नियम दिया जो उन्हीं के नाम पर Kohlrausch का नियम कहलाता है। इस नियम के अनुसार-
अनन्त तनुता पर तुल्यांक चालकता में प्रत्येक आयन का स्वतंत्र रूप से एक निश्चित योगदान होता है और यह योगदान इस आयन के साथ जुड़े दूसरे आयन की प्रकृति पर निर्भर नहीं करता है।
यदि अनन्त तनुता पर धनायन एवं ऋणायन की आयनिक तुल्यांक चालकताएँ क्रमशः λ°c और λ°a हो, तो इस नियम के अनुसार-
अनन्त तनुता पर तुल्यांकी चालकता λ∞ = λ°c +λ°a
यह नियम प्रत्येक तनुता पर सत्य है लेकिन अनन्त तनुता पर ही इसका उपयोग किया जाता है।
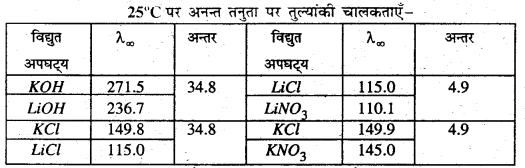
उपर्युक्त सारणी से यह स्पष्ट है कि लिथियम आयन द्वारा पोटैशियम आयन के विस्थापन से का अन्तर 34.8 तथा क्लोराइड आयन के नाइट्रेट आयन के विस्थापन से 4.9 आता है। अतः यह निष्कर्ष निकलता है कि ऋणायनों तथा दो धनायनों के λ∞ का अन्तर सदैव समान होता है चाहे वे क्रमशः किसी धनायन तथा किसी ऋणायन से जुड़े हों।
प्रश्न 6.
Explain the following: (A) The rate of reaction increases with rise in temperature.
(कारण बतावें-(A) अभिक्रिया का वेग ताप बढ़ने से बढ़ता है।)
(B) The rate of reaction increases with increase in concentration of reactants.
(अभिकर्मकों के सांद्रण बढ़ने से अभिक्रिया का वेग बढ़ता है।)
उत्तर:
(A) तापक्रम में वृद्धि के फलस्वरूप प्रतिक्रिया का वेग बढ़ता है। अरहेनियस ने अभिक्रिया के वेग स्थिरांक K और तापक्रम T के बीच एक सम्बन्ध स्थापित किया जो निम्न प्रकार है-
K= Ae-E/RT जहाँ K, अभिक्रिया.का वेग स्थिरांक T, ताप केल्विन में, A, स्थिरांक एवं E, अभिक्रिया का संक्रियण ऊर्जा। इस समीकरण से स्पष्ट है कि तापक्रम में वृद्धि के कारण अभिक्रिया वेग बढ़ता है। ऐसा इसलिए होता है कि सक्रियण ऊर्जा E का मान तापक्रम से प्रभावित नहीं होता है। अतः Tका मान बढ़ने से K का मान बढ़ता है। गैसों के गतिज सिद्धान्त के अनुसार तापक्रम बढ़ने से गतिज ऊर्जा के मान में वृद्धि होती है जिसके कारण प्रभावी टक्करों की संख्या के मान में वृद्धि होती है। इसलिए तापक्रम में वृद्धि होने से अभिक्रिया का वेग बढ़ जाता है।
(B) बलगतिकी सिद्धान्त के अनुसार अभिकारकों के अणुओं के बीच होने वाले टक्करों की संख्या पर अभिक्रिया का वेग निर्भर करता है। अभिकारकों की सान्द्रता बढ़ने से इकाई आयतन में इसके अणुओं की संख्या में वृद्धि होती है जिसके फलस्वरूप प्रभावी टक्करों की संख्या में वृद्धि होती है। इसलिए अभिकारकों (Reactants) की सान्द्रता बढ़ने से अभिक्रिया का वेग बढ़ता है। हम निम्न अभिक्रिया पर विचार करें-
aA + bB → cC
C के बनने का वेग
α[A]a [B]c
= K[A]a [B]c
जब A या B या दोनों के सान्द्रण में वृद्धि होती है तो [A] और [B] के मान में भी वृद्धि होगी। इसलिए C के बनने के वेग में भी वृद्धि होगी। अर्थात् अभिकर्मकों के सान्द्रण में वृद्धि के फलस्वरूप अभिक्रिया का वेग बढ़ता है।
प्रश्न 7.
(A) What are colloids ? How are thus classified ?
(B) Explain the following – (i) Adsorption
(A) कोलॉइड क्या है? उनका वर्गीकरण कैसे किया जाता है ?
(B) निम्नलिखित की व्याख्या करें :
(i) अधिशोषण
उत्तर:
(A) कोलॉइड पदार्थों की एक विशेष व्यवस्था है जिसमें पदार्थों के कणों का आकार 10Å से 103 Å होता है। कोलॉइडी अवस्था को परिभाषित करना कठिन है परन्तु यह कहा जा सकता है कि कोलॉइडी अवस्था दो अमिश्रणीय प्रावस्थाओं का एक विषमांग परिक्षेपण है जो लगभग स्थायी होता है और जिसके कुछ विशेष लक्षण होते हैं। कोलॉइडी अवस्था किसी पदार्थ विशेष के समूह के लिए नहीं प्रयुक्त होता है, वरन् वह एक अवस्था जिसमें लगभग सभी पदार्थों को उपयुक्त विधियों द्वारा लाया जा सकता है। कोलॉइडी अवस्था निलम्बन एवं वास्तविक घोल के बीच वाली अवस्था है।
कोलॉइड का वर्गीकरण निम्न प्रकार किया जाता है-
(a) परिक्षेपण माध्यम के आधार पर :जब परिक्षेपण माध्यम जल, ऐल्कोहॉल एवं बेंजीन होता है तो उसे क्रमशः हाइड्रोसॉल, ऐल्कोसॉल एवं बेंजोसॉल कहते हैं-
(a) परिक्षिप्त प्रावस्था का परिक्षेपण माध्यम के प्रति लगाव के आधार पर दो वर्गों में बाँटा गया है-
(i) द्रव स्नेही :जैसे, जिलेटिन, गम, प्रोटीन, स्टार्च, गोंद इत्यादि।
(ii) द्रव विरोधी धातु, घातु के सल्फाइड, सल्फर, सिल्वर हेलाइड इत्यादि।
(B) (i) अधिशोषण (Adsorption) :
ठोस सतहों द्वारा अन्य पदार्थों (द्रव एवं गैस) को इस प्रकार रोके रहने को, जिसमें ठोस प्रावस्था के आयतन में उनका बेधन न हो, अधिशोषण कहते हैं। जिस ठोस की सतह पर अधिशोषण की क्रिया होती है उसे अधिशोषक कहते हैं तथा जिस पदार्थ का अधिशोषण होता है उसे अधिशोषित कहते हैं।
अधिशोषण की घटना पदार्थ के सतह पर ही होती है। यही कारण है कि सामान्य ठोस की अपेक्षा चूर्ण ठोसों में अधिक क्षेत्र होने के कारण अधिक मात्र में पदार्थ का अधिशोषण होता है। इस घटना के अनेकों उदाहरण हैं। सक्रियता चारकोल द्वारा चीनी का विरंजीकरण, मुल्तानी मिट्टी. द्वारा वानस्पतिक तेलों तथा पेट्रोलियम का शोधन ऐलुमिना द्वारा मिश्रण के विभिन्न घटकों का पृथक्करण आदि अधिशोषण के कुछ महत्त्वपूर्ण उदाहरण हैं।
अधिशोषण दो प्रकार का होता है-
(i) भौतिक अधिशोषण : इसमें गैस ठोस की सतह पर वानडेर वाल्स बलों के द्वारा बंधे रहते हैं।
(ii) रासायनिक अधिशोषण : इसमें ठोस की सतह पर उपस्थित अणुओं या परमाणुओं द्वारा गैस अणु रासायनिक बन्ध से बंधे होते हैं। जैसे-टंग्सटन द्वारा ऑक्सीजन का अधिशोषण।
किसी ठोस की सतह पर गैस की अधिाशोषण निम्न बातों पर निर्भर करता है-
(a) गैस की प्रकृति (b) अधिशोषक की प्रकृति (c) तापक्रम एवं (d) दाब ।
प्रश्न 8.
हैबर विधि से अमोनिया के उत्पादन में निहित सिद्धान्तों की व्याख्या करें। यह निम्न से किस प्रकार प्रतिक्रिया करता है- (i) कॉपर ऑक्साइड (ii) सोडियम क्लोराइड (iii) क्लोरीन (iv) विरंजक चूर्ण (v) कार्बन डाइऑक्साइड (vi) नेसलर प्रतिकारक एवं (vii) सिल्वर क्लोराइडा ।
उत्तर:
हैबर विधि में अमोनिया का उत्पादन नाइट्रोजन एवं हाइड्रोजन के बीच सीधे प्रतिक्रिया कराकर की जाती है।
![]()
यह प्रतिक्रिया उत्क्रमणीय एवं ऊष्माक्षेपी है साथ ही प्रतिक्रिया के फलस्वरूप आयतन में कमी होती है। अतः ली चैटेलियर सिद्धान्त के अनुसार निम्न तापक्रम और उच्च दाब पर अमोनिया का उत्पादन अधिक होगा। यद्यपि निम्न तापमान पर अमोनिया अधिक बनता है लेकिन प्रतिक्रिया की गति बहुत कम होती है जिससे साम्य स्थापित होने में बहुत अधिक समय लगता है। चूंकि अग्रिम प्रतिक्रिया के फलस्वरूप आयतन में कमी होती है. इसलिए उच्च दाब अमोनिया के उत्पादन में सहायक होगा। प्रयोग के आधार पर यह पाया गया है 450°-500°C तापमान पर अमोनिया का उत्पादन अधिकतम होता है इस तापमान को अनुकूलतम तापमान कहते हैं।
लेकिन इस तापमान पर प्रतिक्रिया की गति कम होती है इसलिए प्रतिक्रिया की गति को बढ़ाने के लिए उत्प्रेरक का उपयोग किया जाता है उत्प्रेरक के रूप में फेरिक ऑक्साइड, जिसमें वर्द्धक के रूप में मौल्बिडनम या पोटैशियम एवं एलुमिनियम के ऑक्साइड होते हैं, का उपयोग किया जाता है। अमोनिया के वास्तविक उत्पादन में नाइट्रोजन एवं हाइड्रोजन के 1:3 में बने मिश्रण को फेरिक ऑक्साइड उत्प्रेरक के ऊपर 450°-500°C तापमान 9 एवं लगभग 200 वायुमंडलीय दाब पर प्रवाहित किया जाता है। चूँकि प्रतिक्रिया उत्क्रमणीय है इसलिए प्रतिक्रिया क्षेत्र से अमोनिया को हटाते रहने पर विपरीत दिशा में प्रतिक्रिया नहीं होगी और अमोनिया का उत्पादन अधिक होगा। अमोनिया का उत्पादन 10 से 40 प्रतिशत तक होता है जो दाब पर निर्भर करता है।
(i) कॉपर ऑक्साइड (CuO) के साथ प्रतिक्रिया : गर्म CuO के ऊपर अमोनिया प्रवाहित करने पर CuO अवकृत होकर कॉपर देता है तथा नाइट्रोजन मुक्त होता है।
3CuO + 2NH3 → 3Cu + 3H2O + N2
गर्म अवस्था में अमोनिया Pbo को लेड से अवकृत करता है।
2PbO + 2NH3 → 3Pb + 3H2O+N2
(ii) सोडियम के साथ प्रतिक्रिया : गर्म सोडियम के ऊपर अमोनिया प्रवाहित करने पर सोडामाइड बनता है।
2Na + 2NH3 → 2NaNH2 + H2
(iii) क्लोरीन के साथ प्रतिक्रिया : अमोनिया की अधिक मात्रा के साथ क्लोरीन की प्रतिक्रिया कराने पर नाइट्रोजन बनता है।
8NH3 +3Cl2 → N2 + 6NH4Cl
अमोनिया जब क्लोरीन को अधिक मात्रा के साथ प्रतिक्रिया करता है तो नाइट्रोजन ट्राइक्लोराइड बनता है।
NH3 + 3Cl2 → NCl3 + 3HCl
(iv) विरंजक चूर्ण के साथ प्रतिक्रिया : सान्द्र अमोनिया घोल को गर्म विरंजक चूर्ण पर टपकाने से नाइट्रोजन निकलता है।
2NH3 + 3Ca(OCl)Cl → 3CaCl2 + 3H2O + N2
(v) CO2 के साथ प्रतिक्रिया : अमोनिया एवं CO2 के मिश्रण को गर्म करने पर यूरिया बनता है।
2NH3 + CO2 → NH2 -CO – NH2 + H2O
CO2 को जब अमोनिया के तनु घोल से प्रवाहित किया जाता है तो अमोनियम कार्बोनेट बनता है।
2NH3 + H2O + CO2 → (NH4)2CO3
(vi) नेसलर प्रतिकारक के साथ प्रतिक्रिया : अमोनिया को जब नेसलर प्रतिकारक से प्रवाहित किया जाता है तो भूरा या पीला अवक्षेप प्राप्त होता है।
![]()
(vii) सिल्वर क्लोराइड के साथ प्रतिक्रिया : अमोनिया के जलीय घोल में AgCl घुलकर घुलनशील जटिल लवण डाइएमीनो सिल्वर क्लोराइड बनाता है।
AgCl +2NH3 → [Ag(NH3)4]Cl
प्रश्न 9.
How H2Sgas is prepared in laboratory ? Why nitric acid is not used in the preparation of H2S? How does it react with the following (a) SO2 (b) Halogen (c) Ferric chloride solution (d) Acidic KMnO solution
(e) Acidic K2Cr2O7 solution (f) Lead acetate solution.
प्रयोगशाला में H2S गैस कैसे बनाया जाता है ? H2S बनाने में नाइट्रिक अम्ल का उपयोग क्यों नहीं किया जाता है ? निम्न से यह किस प्रकार प्रतिक्रिया करता है
(a) सल्फर डाइऑक्साइड (b) हैलोजन (c) फेरिक क्लोराइड घोल (d) अम्लीय KMnO4 घोल (e) अम्लीय K2Cr2O7 घोल (f) लेड ऐसीटेट घोला :
उत्तर:
प्रयोगशाला में फेरस सल्फाइड पर तनु गन्धकाम्ल या तनु हाइड्रोक्लोरिक अम्ल (1 : 3) की प्रतिक्रिया कराकर हाइड्रोजन सल्फाइड गैस बनाया जाता है।
FeS + H2SO4 → FeSO2 + H2S
FeS + 2HCl → FeCl2 + H2S
H2S बनाने में सान्द्र H2SO4 का प्रयोग नहीं किया जा सकता है क्योंकि यह H2S को सल्फर में ऑक्सीकृत कर देता है।
H2SO4 + H2S → 2H2O + S +SO2
नाइट्रिक अम्ल की प्रतिक्रिया फेरस सल्फाइड के साथ कराकर हाइड्रोजन सल्फाइड नहीं बनाया जा सकता है क्योंकि यह H2S को गन्धक में ऑक्सीकृत कर देता है क्योंकि HNO3 एक ऑक्सीकारक है।
Fes + 2HNO3 → Fe(NO3)2 + H2S
H2S +2HNO3 → 2H2O + 2NO2 + S
प्राप्त H2S गैस में अल्प मात्रा में हाइड्रोजन भी होता है क्योंकि फेरस सल्फाइड में अल्प मात्रा में लोहा अशुद्धि के रूप में रहता है।
Fe + H2SO4 → FeSO4 + H2
आर्द्र गैस को शुष्क करने के लिए इसे CaCl2 या P2O5 पर प्रवाहित किया जाता है। इसे सान्द्र H2SO4 से प्रवाहित कर शुष्क नहीं किया जा सकता है क्योंकि यह H2SO4 के द्वारा सल्फर में ऑक्सीकृत हो जाता है।
H2S + H2SO4 → 2H2O + SO2+ S
इसे हवा के विस्थापन के द्वारा जमा किया जाता है क्योंकि यह हवा से भारी होता है। जल में कुछ हद तक घुलनशील होने के कारण इसे जल के विस्थापन द्वारा जमा नहीं किया जा सकता है। प्रयोगशाला में इसे किस उपकरण के द्वारा प्राप्त किया जाता है क्योंकि इससे जब भी जरूरत हो H2S गैस प्राप्त किया जा सकता है।
गुण : (a) यह SO2 को सल्फर में अवकृत करता है।
2H2S + SO2 → 2H2O + 3S
(b) यह हैलोजनों को उनके हाइड्रा अम्ल में अवकृत कर देता है।
H2S + Cl2 → 2HCl + S
H2S + Br2 → 2HBr + S
H2S – I2 → 2HI + S
(c) यह फेरिक क्लोराइड को फेरस क्लोराइड में अवकृत करता है।
2FeCl3 + H2S → 2FeCl2 + 2HCl + S
(d) यह अम्लीय पोटैशियम परमैंगनेट घोल को रंगहीन कर देता है, साथ ही Mn (VII) को Mn (II) में अवकृत करता है।
2KMnO4 +3H2SO4 + 5H2S → K2SO4 + 2MnSO4 + 8H2O + 5S
(e) यह अम्लीय पोटैशियम डाइक्रोमेट के घोल को हरा कर देता है। ऐसा Cr (VI) के Cr (III) में अवकरण के कारण होता है।
K2Cr2O7 + 4H2SO4 + 3H2S → KSO4 + Cr2(SO4)3 + 7H2O + 3S
(f) लेड ऐसीटेट के घोल में जब H2S गैस प्रवाहित किया जाता है तो लेड सल्फाइड का काला अवक्षेप बनता है।
Pb(CH3COO)2 + H2S → PbS ↓+ 2CH3COOH
प्रश्न 10.
प्रयोगशाला में फॉर्मल्डिहाइड कैसे बनाया जाता है ? यह निम्न के साथ किस प्रकार प्रतिक्रिया करता है ? (a) हाइड्रोसानिक अम्ल (HCN) (b) सोडियम बाइसल्फाइट (c) हाइड्रॉक्सिल ऐमीन (d) अम्लीय K2Cr2O7 (e) अमोनिकल AgNO3 घोल (f) फेहलिंग घोल (g) अमोनिया (h) NaOH (i) फिनाइल हाइड्राजीन।
उत्तर:
प्रयोगशाला में फॉल्डिहाइड बनाने के लिए मिथाइल एल्कोहल का ऑक्सीकरण प्लैटिनम उत्प्रेरक की उपस्थिति में हवा के द्वारा किया जाता है।
![]()
निर्जल कैल्सियम ऐसीटेट का शुष्क स्रवण करके भी प्रयोगशाला में फॉल्डिहाइड बनाया जाता है।
Ca(CH3COO)2 → HCHO + CaCO3
(a) हाइड्रोसायनिक अम्ल के साथ प्रतिक्रिया :फॉर्मल्डिहाइड हाइड्रोसायनिक अम्ल से प्रतिक्रिया कर फॉर्मल्डिहाइड सायनोहाइड्रीन बनाता है।
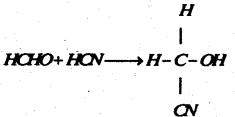
(b) सोडियम बाइसल्फाइट के साथ प्रतिक्रिया : सोडियम बाइसल्फाइट के संतृप्त घोल के साथ ठंडी अवस्था में प्रतिक्रिया कर यह फॉर्मल्डिहाइड सोडियम बाइसल्फाइट के सफेद रवे बनाता है।
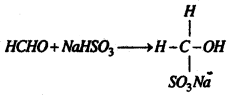
(c) हाइड्रॉक्सिल ऐमीन के साथ प्रतिक्रिया : यह हाइड्रॉक्सिल ऐमीन के जलीय घोल के साथ प्रतिक्रिया कर फार्मल्डॉक्जाइम बनाता है।
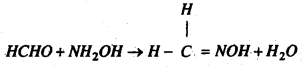
(d) अम्लीय K2Cr2O7 के साथ प्रतिक्रिया : अम्लीय K2Cr2O7 फॉल्डिहाइड को फॉर्मिक अम्ल में ऑक्सीकृत करता है।
![]()
(e) अमोनिया सिल्वर नाइट्रेट पोल के साथ प्रतिक्रिया : फॉल्डिहाइड को जब अमोनिकल सिल्वर नाइट्रेट घोल के साथ गर्म किया जाता है तो फॉर्मिक अम्ल बनता है तथा सिल्वर मुक्त होता है।
![]()
(f) फेहलिंग घोल के साथ प्रतिक्रिया :फॉल्डिहाइड को जब फेहलिंग घोल के साथ गर्म किया जाता है तो क्यूप्रस क्लोराइड का लाल अवक्षेप बनता है।
![]()
(g) अमोनिया के साथ प्रतिक्रिया : फॉर्मल्डिहाइड अमोनिया के साथ प्रतिक्रिया कर हेक्सामिथिलीन टंट्रामीन का श्वेत रखे बनाता है।
6HCHO+ 4NH3 → (CH2)6N4 + 6H2O
(h) सोडियम हाइड्रॉक्साइड के साथ प्रतिक्रिया : फॉमल्डिहाइड सोडियम हाइड्रॉक्साइड के सान्द्र घोल के साथ प्रतिक्रिया कर मिथाइल एल्कोहल एवं सोडियम फॉर्मेट बनाता है। इस प्रतिक्रिया को कैनिजारो प्रतिक्रिया कहते हैं। इसमें फॉमल्डिहाइड के एक अणु का अवकरण और दूसरे को ऑक्सीकरण होता है।
2HCHO + NaOH → CH3OH + HCOONa
(i) फिनाइल हाइड्रॉजीन के साथ प्रतिक्रिया : ऐसीटिक अम्ल के घोल में फॉर्मल्डिहाइड एवं फिनाइल हाइड्रॉजीन आपस में प्रतिक्रिया कर फॉल्डिहाइड फिनाइल हाइड्रोजन बनाता है।
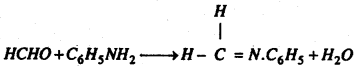
प्रश्न 11.
प्रयोगशाला में फॉर्मिक अम्ल कैसे बनाया जाता है? यह निम्न के साथ किस प्रकार प्रतिक्रिया करता है ? (i) अमोनिया (ii) PCl5 (iii) अमोनिकल AgNO3 घोल (iv) फेहलिंग घोल (v) सान्द्र गन्धकाम्ल।
उत्तर:
ग्लिसरॉल एवं ऑक्जैलिक अम्ल के रवों को जब 100°C से 110°C के बीच स्रवण किया जाता है तो फॉर्मिक अम्ल बनता है। प्रतिक्रिया तीन चरणों में होती है। प्रथम चरण में ऑक्जैलिक अम्ल ग्लिसरॉल के साथ प्रतिक्रिया कर ग्लिसरॉल मोनोऑक्जैलेट बनाता है।

दूसरे चरण में 110°C पर ग्लिसरॉल मोनोऑक्जैलेट विघटित होकर ग्लिसरॉल मोनो फॉर्मेट में बदल जाता है।

तीसरे चरण में ग्लिसरॉल मोनो फॉर्मेट जल अपघटित होकर फॉर्मेट अम्ल देता है। CH2OOCH
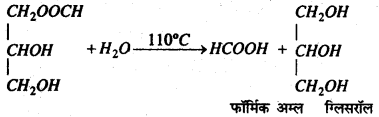
स्रवण फ्लास्क में 50 ग्राम रवेदार ऑक्जैलिक अम्ल और 40 मि० ली० निर्जल ग्लिसरॉल लेकर मिश्रण को 100°C से 100°C तक गर्म किया जाता है। प्रारम्भ में CO2 तेजी से निकलती है। जब CO2 का निकलना मन्द होने लगता है तो फ्लास्क को थोड़ा ठंडा कर उसमें ऑक्जैलिक अम्ल के कुछ रवे डाल दिये जाते हैं। अब मिश्रण का 100°C, 100°C के बीच किया जाता है। फॉर्मिक अम्ल ग्राहक के द्रव के रूप में जमा होता है। निर्जल फॉर्मिक अम्ल बनाने के लिए स्रावित द्रव को लिथार्ज के साथ गर्म किया जाता है। घोल को छानकर छनित का रवाकरण करने पर लेड फॉमेंट के रवे प्राप्त होते हैं।
2HCOOH + PbO → Pb(HCOO)2 +H2O
इन रवों को सुखाने के बाद लीबिंग संघनित के भीतर नली में भरकर इसे जलवाष्प के द्वारा गर्म किया जाता है और नली में शुष्क H2S गैस प्रवाहित की जाती है। प्रतिक्रिया के फलस्वरूप फॉर्मिक अम्ल बनता है जो ग्राहक में जमा होता है। इसमें ताजा लेड फॉर्मेट डालकर मिश्रण का स्रवण करने पर शुष्क फॉर्मिक अम्ल प्राप्त होता है।
Pb(HCOO)2 + H2S → 2HCOOH + Pbs
(i) अमोनिया के साथ प्रतिक्रिया : फॉर्मिक अम्ल की प्रतिक्रिया अमोनिया के साथ कराने पर अमोनियम फॉर्मेट बनता है।
![]()
(ii) PCl5 के साथ प्रतिक्रिया : फॉर्भिक अम्ल PCl5 के साथ प्रतिक्रिया कर फॉर्माइल क्लोराइड बनाता है।
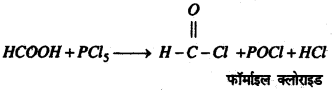
फॉर्माइल क्लोराइड कमरे के तापमान पर अस्थाई होने के कारण यह कार्बन मोनॉक्साइड एवं HCl में विघटित हो जाता है

(iii) अमोनिकल सिल्वर नाइट्रेट घोल के साथ प्रतिक्रिया : फॉर्मिक अम्ल को जब अमोनिकल सिल्वर नाइट्रेट घोल के साथ गर्म किया जाता है तो यह घोल में उपस्थित Ag2O को Ag में अवकृत कर देता है। सिल्वर धातु परखनली की सतह पर रजत दर्पण के रूप में जमा होता है।
HCOOH + Ag2O → 2Ag + H2O + CO2
(iv) फेहलिंग घोल के साथ प्रतिक्रिया : फॉर्मिक अम्ल को जब फेहलिंग घोल के साथ गर्म किया जाता है तो यह फेहलिंग घोल में उपस्थित Cu(OH)2 को क्युप्रस ऑक्साइड Cu2O में अवकृत करता है जो लाल अवक्षेप के रूप में प्राप्त होता है।
![]()
(v) सान्द्र H2SO4 (गन्धकाम्ल) के साथ प्रतिक्रिया : फॉर्मिक अम्ल को जब सान्द्र H2SO4 के साथ गर्म किया जाता है तो यह जल और कार्बन मोनोक्साइड में विघटित होता है।
![]()