Bihar Board Class 12 Chemistry Solutions Chapter 5 पृष्ठ रसायन Textbook Questions and Answers, Additional Important Questions, Notes.
BSEB Bihar Board Class 12 Chemistry Solutions Chapter 5 पृष्ठ रसायन
Bihar Board Class 12 Chemistry पृष्ठ रसायन Text Book Questions and Answers
पाठयनिहित प्रश्न एवं उनके उत्तर
प्रश्न 5.1
रसोवशोषण के दो अभिलक्षण दीजिए।
उत्तर:
अवशोषण के लक्षण (Characteristics of Chemisorption)
1. उच्च विशिष्टता (High Specificity):
रसोवशोषण अतिविशिष्ट होता है तथा यह केवल तभी होता है जब अधिशोषक एवं अधिशोष्य के मध्य रासायनिक बन्ध बनने की कोई सम्भावना हो। उदाहरणार्थ-आक्सीजन धातुओं पर आक्साइड बनने के कारण अधिशोषित होती है एवं हाइड्रोजन का संक्रमण, धातुओं द्वारा अवशोषण हाइड्राइड बनने के कारण होता है।
2. अनुत्क्रमणीयता (Irreversibility):
रसोवशोषण में यौगिक बनने के कारण इसकी प्रकृति अनुत्क्रमणीय होती है। रसोवशोषण एक ऊष्माक्षेपी प्रक्रम है, परन्तु उच्च सक्रियण ऊर्जा के कारण निम्न तापों से यह बहुत धीमा होता है।
अधिकतर रासायनिक परिवर्तनों के समान अधिशोषण ताप बढ़ने पर प्रायः बढ़ता निम्न ताप पर गैस का भौतिक अधिशोषण, उच्च ताप पर रसोवशोषण में परिवर्तित हो सकता है। साधराणतया उच्च दाब भी रसोवशोषण के लिए अनुकूल होता है।
![]()
प्रश्न 5.2
ताप बढ़ने पर भौतिक अधिशोषण क्यों घटता है।
उत्तर:
भौतिक अधिशोषण एक ऊष्माक्षेपी प्रक्रम है। चूँकि ला-शातैलिए सिद्धान्त के अनुसार, ताप बढ़ाने से सान्य पश्चगामी दिशा में अग्रसर होगा अर्थात् गैस अधिशोषित सतह से विमुक्त हो जाएगी। अत: ताप बढ़ने पर अधिशोषण घटता है।
प्रश्न 5.3
अपने क्रिस्टलीय रूपों की तुलना में चूर्णित पदार्थ अधिक प्रभावी अधिशोषक क्यों होते हैं?
उत्तर:
चूँकि चूर्णित पदार्थों का पृष्ठीय क्षेत्रफल उनके क्रिस्टलीय रूपों की तुलना में अधिक होता है। अतः चूर्णित पदार्थों की अधिशोषण क्षमता अधिक होती है। उदाहरण – चारकोल, सिलिका, जेल, ऐलुमिना जेल, सूक्ष्म विभाजित धातुएँ आदि अच्छे अधिशोषक हैं।
प्रश्न 5.4
अमोनिया प्राप्त करने के लिए हॉबर प्रक्रम में CO को हटाना क्यों आवश्यक है?
उत्तर:
अमोनिया प्राप्त करने के लिए हॉबर प्रक्रम में CO उत्प्रेरक विष का कार्य करता है। अतः इसे हटाना आवश्यक है।
प्रश्न 5.5
एस्टर का जल-अपघटन प्रारम्भ में धीमा एवं कुछ समय पश्चात् तीव्र क्यों हो जाता है?
उत्तर:
एस्टर का जल-अपघटन निम्नलिखित प्रकार होता है:

इस अभिक्रिया में उत्पन्न अम्ल (RCOOH) अभिक्रिया के लिए स्वउत्प्रेरक की भांति कार्य करता है, जिससे अभिक्रिया तीव्र हो जाती है।
![]()
प्रश्न 5.6
उत्प्रेरण के प्रक्रम में विशोषण की क्या भूमिका है?
उत्तर:
विशोषण से उत्प्रेरक की सतह पर उत्पन्न अभिक्रिया उत्पाद सतह से अलग हो जाते हैं। इसके फलस्वरूप पृष्ठ पुनः अभिक्रिया के आयनों के लिए उपलब्ध हो जाता है और पुनः उत्पाद उत्पन्न हो जाते हैं।
प्रश्न 5.7
आप हार्डी शुल्से नियम में संशोधन के लिए क्या सुझाव दे सकते हैं?
उत्तर:
ऊर्णन शक्तियों की तुलना के लिए तो कोलॉइडी कणों के आवेश को उदासीन करने वाले आयनों की कोलॉइडी कणों के पृष्ठों पर अधिशोषित होने की प्रवृत्तियों में बहुत अधिक अन्तर नहीं होना चाहिए।
प्रश्न 5.8
अवक्षेप का मात्रात्मक आकलन करने से पूर्व उसे जल में धोना आवश्यक क्यों है?
उत्तर:
अवक्षेप के बनने में विद्युत-अपघट्य की कुछ मात्रा अवक्षेप के पृष्ठ पर अधिशोषित हो जाती है। अत: इन विद्युत-अपघट्य तथा अन्य अशुद्धियों को हटाने के लिए अवक्षेप को जल से धोकर मात्रात्मक आकलन करना आवश्यक है।
Bihar Board Class 12 Chemistry पृष्ठ रसायन Additional Important Questions and Answers
अभ्यास के प्रश्न एवं उनके उत्तर
प्रश्न 5.1
अधिशोषण एवं अवशोषण शब्दों (पदों) के तात्पर्य में विभेद कीजिए। प्रत्येक का एक उदाहरण दीजिए।
उत्तर:
अधिशोषण तथा अवशोषण में अन्तर:

प्रश्न 5.2
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में क्या अन्तर है?
उत्तरः
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में अन्तर:

![]()
प्रश्न 5.3
कारण बताइए कि सूक्ष्म-विभाजित पदार्थ अधिक प्रभावी अधिशोषक क्यों होता है?
उत्तर:
अधिशोषण निश्चित रूप से एक पृष्ठीय परिघटना है। सूक्ष्म विभाजित पदार्थों का पृष्ठीय क्षेत्रफल अधिक होने के कारण उनकी अधिशोषण क्षमता अधिक होती है। उदाहरणार्थ-चारकोल, सिलिका जेल, मिट्टी, कोलॉइड सूक्ष्म-विभाजित धातुएँ आदि अच्छे अधिशोषक का कार्य करते है।
प्रश्न 5.4
किसी ठोस पर गैस के अधिशोषण को प्रभावित करने वाले कारक कौन-से हैं?
उत्तर:
गैस के अधिशोषण को प्रभावित करने वाले कारक:
- गैस की प्रकृति
- अधिशोषक का पृष्ठीय क्षेत्रफल
- अधिशोषक की सक्रियता
- ताप
- दाब
प्रश्न 5.5
अधिशोषण समतापी वक्र क्या है? फ्रॉयन्डलिक अधिशोषणा समतापी वक्र का वर्णन कीजिए।
उत्तर:
अधिशोषण समतापी वक्र:
अधिशोषक के प्रति ग्राम में अधिशोषित गैस की मात्रा तथा स्थिर ताप पर अधिशोष्य (गैस) के दाब के बीच खींचा गया वक्र अधिशोषण समतापी वक्र कहलाता है।
फ्रॉयन्डलिक समतापी वक्र (Freundlich Adsorption Isotherm):
फ्रॉयन्डलिक ने 1909 में ठोस अधिशोषक के इकाई द्रव्यमान द्वारा एक निश्चित ताप पर अधिशोषित गैस की मात्रा एवं दाब के मध्य एक प्रयोग पर आधारित सम्बन्ध दिया। सम्बन्ध को निम्नलिखित समीकरण द्वारा व्यक्त किया जा सकता है –
\(\frac{x}{m}\) = kp1/n (n > 1) ………………. (i)
जहाँ x अधिशोषक के m द्रव्यमान द्वारा p दाब पर अधिशोषित गैस का द्रव्यमान है। k एवं n स्थिरांक हैं जो कि किसी निश्चित ताप पर अधिशोषक एवं गैस की प्रकृति पर निर्भर करते हैं।
सम्बन्ध को सामान्यता एक वक्र के रूप में निरूपित किया जाता है जिसमें अधिशोषक के प्रति ग्राम द्वारा अधिशोषित गैस का द्रव्यमान दाब के विपरीत आलेखित किया जाता है। ये वक्र व्यक्त करते हैं कि एक निश्चित दाब पर, ताप बढ़ाने से भौतिक अधिशोषण घटता है। ये वक्र सदैव उच्च दाब पर सदैव संतृप्तता की ओर बढ़ते प्रतीत होते हैं।

चित्र: अधिशोषण समतापी वक्र समीकरण (1) का लघुगणक लने पर –
log \(\frac{x}{m}\) = log k + \(\frac{1}{n}\) log p …………….. (ii)
फ्रॉयन्डलिक समतापी वक्र की वैधता, आलेख में log: \(\frac{x}{m}\) को y – अक्ष (कोटि) एवं log p को x – अक्ष (भुज) पर लेकर प्रमाणित की जा सकती है। यदि यह एक सीधी रेखा आती है तो फ्रॉयन्डलिक वक्र प्रमाणित है, अन्यथा नहीं। चित्र में, सीधी रेखा के ढाल \(\frac{1}{n}\) का मान देता है। y – अक्ष पर अन्त:खण्ड logk का मान देता है।

चित्र-फ्रॉयन्डलिक समतापी फ्रॉयन्डलिक समतापी अधिशोषण के व्यवहार की सन्निकट व्याख्या करता है। गुणक \(\frac{1}{n}\) का मान 0 एवं 1 के मध्य हो सकता है (अनुमानित सीमा 0.1 से 0.5)। अत: समीकरण (2) दाब के सीमित विस्तार तक ही लागू होती है।
(क) जब \(\frac{1}{n}\) = 0, \(\frac{x}{m}\) = स्थिरांक, अत: अधिशोषण दाब से स्वतन्त्र है।
(ख) \(\frac{1}{n}\) = 1, \(\frac{x}{m}\) = kp अर्थात् \(\frac{x}{m}\) ∝ p, अतः अधिशोषण में परिवर्तन दाब के अनुक्रमानुपाती है।
दोनों ही प्रतिबन्धों का प्रायोगिक परिणामों से समर्थन होता है। प्रायोगिक समतापी सदैव उच्च दाब पर संतृप्ता की ओर अभिगमन करते प्रतीत होते हैं। इसे फ्रॉयन्डलिक समतापी से नहीं समझाया जा सकता। इस प्रकार यह उच्च दाब पर असफल हो जाता है।
![]()
प्रश्न 5.6
अधिशोषक के सक्रियण से आप क्या समझते हैं? यह कैसे प्राप्त किया जाता है?
उत्तर:
अधिशोषक के सक्रियण से तात्पर्य अधिशोषक की अधिशोषण क्षमता को बढ़ाना है। इसे अधिशोषक के पृष्ठीय क्षेत्रफल को बढ़ाकर किया जा सकता है। अधिशोषक के पृष्ठीय क्षेत्रफल को निम्नलिखित विधियों द्वारा बढ़ाया जा सकता हैं –
- अधिशोषित गैसों को हटाकर अर्थात् चारकोल को 650K से 1330 K के मध्य ताप पर निर्गत अथवा अतितप्त भाप में गर्म करके सक्रिय किया जा सकता है।
- अधिशोषक को बारीक पीसकर अर्थात् सूक्ष्म विभाजित करके इसकी अधिशोषण क्षमता बढ़ाई जा सकती है।
- अधिशोषक की सतह को खुरदरा करके भी इसकी अधिशोषण क्षमता अर्थात् सक्रियता बढ़ाई जा सकती है।
प्रश्न 5.7
विषमांगी उत्पेरण में अधिशोषण की क्या भूमिका है?
उत्तर:
यह सिद्धान्त अधिशोषण की भूमिका को स्पष्ट करता है। इस सिद्धान्त के अनुसार गैसीय प्रावस्था या वियलन में अभिकारक, ठोस उत्प्रेरक के पृष्ठ पर अधिशोषित हो जाते हैं। पृष्ठ पर अभिकारकों की सांद्रता में वृद्धि अभिक्रिया की दर को बढ़ा देती है। अधिशोषण एक ऊष्माक्षेपी अभिक्रिया है; अतः अधिशोषण की ऊष्मा, अभिक्रिया की दर बढ़ाने में प्रयुक्त हो जाती है।
आधुनिक अधिशोषण सिद्धान्त के अनुसार उत्प्रेरण क्रिया उत्प्रेरक की सतह पर केन्द्रित होती है। इस क्रियाविधि में पाँच पद सम्मिलित होते हैं –
- उत्प्रेरक की सतह पर अभिकारक का विसरण।
- उत्प्रेरक की सतह पर अभिकारक अणुओं का अधिशोषण।
- एक मध्यवर्ती निर्माण द्वारा उत्प्रेरक की सतह पर रासायनिक अभिक्रिया का होना।
- उत्प्रेरक सतह से अभिक्रिया उत्पादों का विशेषण होने के बाद सतह का दोबारा अधिक अभिक्रिया होने के लिए उपलब्ध कराना।
- अभिक्रिया उत्पादों का उत्प्रेरक की सतह से दूर विसरण।
उत्प्ररेक की सतह पर मुक्त संयोजकताएँ होती हैं। ये स्थूल के आन्तरिक भाग में नहीं होती हैं। यह संयोजकताएँ रासायनिक आकर्षण बलों के लिए स्थान उपलब्ध कराती हैं।
जब कोई गैस एक ऐसी सतह के सम्पर्क में आती है तो इसके अणु शिथिल रासायनिक संयोजन के कारण वहाँ बँध जाते हैं। यदि अलग प्रकार के अणु पास-पास अधिशोषित हो जाएं तो एक दूसरे से अभिक्रिया कर सकते हैं जिससे नए अणु बन जाते हैं। इस प्रकार बने अणु सतह को नए अभिकारक अणुओं के लिए छोड़ते हुए वाष्पीकृत हो जाते हैं।

चित्र-अभिकारी अणुओं का अधिशोषण, मध्यवर्ती का बनना एवं उत्पादों का विशोषण यह सिद्धान्त स्पष्ट करता है कि अभिक्रिया के अन्त में उत्प्रेरक का द्रव्यमान एवं रासायनिक संघटन अपरिवर्तित रहता है तथा यह काम मात्रा में भी किस प्रकार प्रभावी होता है।
![]()
प्रश्न 5.8
अधिशोषण हमेशा ऊष्माक्षेपी क्यों होता है?
उत्तर:
अधिशोषण होने पर पृष्ठ के अवशिष्ट बलों में सदैव कमी आती है अर्थात् पृष्ठ ऊर्जा में कमी आती है जो कि ऊष्मा के रूप में प्रकट होती है। अत: अधिशोषण सदैव एक ऊष्माक्षेपी प्रक्रम होता है।
दूसरे शब्दों में, अधिशोषण का ∆H हमेशा ऋणात्मक होता है। जब एक गैस अधिशोषित होती है, तो इसके अणुओं का संचलन सीमित हो जाता है, इससे अधिशोषण के पश्चात् गैस की ऐन्ट्रॉपी घट जाती है। किसी प्रक्रम के स्वतः प्रवर्तित होने के लिए, ऊष्मागतिकीय आवश्यकता यह है कि स्थिर ताप एवं दाब पर ∆G ऋणात्मक होना चाहिए अर्थात् गिब्ज़ ऊर्जा में कमी होनी चाहिए।
समीकरण ∆G = ∆H – T∆S के आधार पर ∆G तभी ऋणात्मक हो सकता है जब ∆H का मान पर्याप्त ऋणात्मक हो, क्योंकि – T∆S का मान धनात्मक है। अतः अधिशोषण प्रक्रम में, जो कि स्वत: प्रवर्तित होता है, इन दोनों गुणकों का संयोजन ∆G को ऋणात्मक बनाता है। जैसे-जैसे अधिशोषण बढ़ता है, ∆H कम ऋणात्मक होता जाता है एवं अन्त में ∆H, T∆S के तुल्य हो जाता है एवं ∆ का मान शून्य हो जाता है। इस अवस्था पर साम्य स्थापित हो जाता है।
![]()
प्रश्न 5.9
कोलॉइडी विलयनों को परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर कैसे वर्गीकृत किया जाता है?
उत्तर:
परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्था के आधार पर वर्गीकरण:
परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर आठ प्रकार के कोलॉइडी तन्त्र सम्भव हैं। एक गैस का दूसरी गैस के साथ मिश्रण समांगी होता है, अतः यह कोलॉइडी तन्त्र नहीं होता। विभिन्न प्रकार के कोलॉइडी के उदाहरण उनके विशिष्ट नामों सहित अग्रांकित सारणी में दिए गए है।
सारणी-कोलॉइडी तन्त्रों के प्रकार:
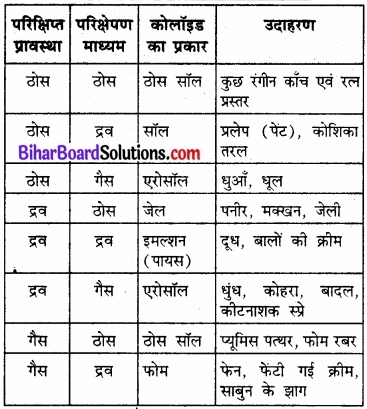
अनेक परिचित व्यावसायिक उत्पादन एवं प्राकृतिक वस्तुएँ कोलॉइड हैं। उदाहरणार्थ – फेंटी हुई क्रीम झाग है, जिसमें गैस, द्रव में परिक्षिप्त है। हवाई जहाजों के अपात्कालीन अवतारण (Emergency landing) के समय उपयोग किए जाने वाले अग्निशामक फोम भी कोलॉइडी होते हैं। अधिकांश जैविक तरल, जलीय सॉल (जल परिक्षिप्त ठोस) होते हैं। एक प्रारूपी कोशिका में उपस्थित प्रोटीन एवं न्यूक्लीक अम्ल कोलॉइड के आकार के कण होते हैं, जो आयनों एवं लघु अणुओं के जलीय विलयन में परिक्षिप्त होते हैं।
प्रश्न 5.10
ठोसों द्वारा गैसों के अधिशोषण पर दाब एवं ताप के प्रभाव की विवेचना कीजिए।
उत्तर:
अधिशोषण पर दाब का प्रभाव (Effect of pressure on adsorption):
स्थिर ताप पर किसी ठोस में किसी गैस के अधिशोषण का अंश दाब के साथ बढ़ता है। स्थिर ताप पर ठोस में गैस के अधिशोषण के अंश (\(\frac{x}{m}\)) तथा गैस के दाब (p) के मध्य खींचा गया ग्राफ अधिशोषण समतापी वक्र कहलाता है।
फ्रॉयन्डलिक समतापी वक्र (Freundlich Isotherm):
1. दाब की न्यूनतम परास में \(\frac{x}{m}\) आरोपित दाब के अनुक्रमानुपाती होता है।
\(\frac{x}{m}\) p’
2. दाब के उच्च परास में \(\frac{x}{m}\) आरोपित दाब पर निर्भर नहीं करता है।
\(\frac{x}{m}\) p0
3. दाब के माध्यमिक परास में \(\frac{x}{m}\) का मान दाब की भिन्नात्मक घात के समानुपाती होता है।
\(\frac{x}{m}\) P1n
जहाँ \(\frac{1}{n}\) एक भिन्न है। इसका मान 0 से 1 के बीच हो सकता

अधिशोषण पर ताप का प्रभाव (Effect of temperature on adsorption):
अधिशोषण सामान्यतया ताप पर निर्भर होता है। अधिकांश अधिशोषण प्रक्रम ऊष्माक्षेपी होते हैं तथा इसलिए ताप बढ़ाने पर अधिशोषण घट जाता है। यद्यपि ऊष्माशोषी अधिशोषण प्रक्रमों में अधिशोषण ताप बढ़ने पर बढ़ जाता है।
![]()
प्रश्न 5.11
द्रवरागी एवं द्रवविरागी सॉल क्या होते हैं? प्रत्येक का एक-एक उदाहरण दीजिए। द्रवविरोधी सॉल आसानी से स्कन्दित क्यों हो जाते हैं?
उत्तर:
द्रवरागी सॉल:
द्रवरागी शब्द का अर्थ है द्रव को स्नेह करने वाला। गोंद, रबर आदि जैसे पदार्थों को उचित द्रव (परिक्षेपण माध्यम) में मिलाने पर सीधे ही प्राप्त होने वाले कोलॉइडी सॉल द्रवरागी कोलॉइड कहलाते हैं।
सॉल की एक महत्त्वपूर्ण विशेषता यह होती है कि यदि परिक्षेपण माध्यम को परिक्षिप्त प्रावस्था से अलग कर दिया जाए (माना वाष्पीकरण द्वारा) तो सॉल को केवल परिक्षेपण माध्यम के साथ मिश्रित करके पुन: प्राप्त किया जा सकता है। ऐसे सॉल को उत्क्रमणीय सॉल भी कहते हैं। इसके अतिरिक्त, ये सॉल पर्याप्त स्थायी होते हैं एवं इन्हें आसानी से स्कन्दित नहीं किया जा सकता है।
उदाहरण: गोंद जिलेटिन, स्टार्च, रबर आदि।
द्रवविरागी या द्रवविरोधी सॉल:
द्रवविरागी शब्द का अर्थ है द्रव से घृणा करने वाला। धातुएँ एवं उनके सल्फाइड आदि जैसे पदार्थ, केवल परिक्षेपण माध्यम में मिश्रित करने से कोलॉइडी सॉल नहीं बनाते। इनके कोलॉइडी सॉल केवल विशेष विधियों द्वारा ही बनाए जा सकते हैं। ऐसे सॉल को द्रवविरागी सॉल कहते हैं।
ऐसे सॉल को वैद्युत अपघट्य की थोड़ी सी मात्रा मिलाकर, गर्म करके या हिलाकर आसानी से अवक्षेपित (या स्कन्दित) किया जा सकता है इसलिए ये स्थायी नहीं होते। इसके अतिरिक्त एक बार अवक्षेपित होने के बाद ये केवल परिक्षेपण माध्यम के मिलाने पर मात्र से पुनः कोलॉइडी सॉल नहीं देते। अतः इनको अनुत्क्रमणीय सॉल भी कहते हैं। द्रवविरागी सॉल के परीक्षण के लिए स्थायी कारकों की आवश्यकता होती है।
उदाहरण:
गोल्ड, सिल्वर, Fe(OH)3. AS2O3 आदि।
द्रवविरोधी सॉल का स्कन्दन (Coagulation of Lyophobic Sols) द्रवविरोधी सॉल का स्थायित्व केवल कोलॉइडी कणों पर आवेश की उपस्थिति के कारण होता है। यदि किसी प्रकार आवेश हटा दिया जाए तो कण एक-दूसरे के समीप आकर पुंजित हो जाएँगे और ये स्कन्दित होकर नीचे बैठ जाएँगे। द्रवरागी सॉल का स्थायित्व कोलॉइड कणों के आवेश के साथ-साथ उनके विलायकयोजन के कारण होता है। इन दोनों कारकों को हटाने से इन्हें स्कन्दित किया जा सकता है। अतः द्रवविरोधी सॉल आसानी से स्कन्दित हो जाते हैं।
![]()
प्रश्न 5.12
बहुअणुक एवं वृहदाणुक कोलॉइड में क्या अन्तर है? प्रत्येक का एक-एक उदाहरण दीजिए। सहचारी कोलॉइड इन दोनों प्रकार के कोलॉइडों से कैसे भिन्न हैं?
उत्तर:
बहुअणुक तथा वृहदाणुक कोलॉइड में अन्तर बहुअणुक कोलॉइड:
विलीन करने पर किसी पदार्थ के बहुत से परमाणु या लघु अणु एकत्रित होकर पुंज जैसी ऐसी स्पीशीज बनाते हैं जिनका आकार (साइज) कोलॉइडी सीमा (व्यास < 1nm) में होता है। इस प्रकार प्राप्त स्पीशीज बहुअणुक कोलॉइड कहलाती हैं।
उदाहरण:
एक गोल्ड सॉल में अनेक परमाणु युक्त भिन्न-भिन्न आकारों के कण हो सकते हैं। सल्फर सॉल में एक हज़ार या उससे भी अधिक S सल्फर अणु वाले कण उपस्थित रहते हैं।
वृहदाणुक कोलॉइड:
वृहदाणुक उचित विलायकों में ऐसे विलयन बनाते हैं जिनमें वृहदाणुओं का आकार कोलॉइडी सीमा में होता है, ऐसे निकाय वृहदाणुक कोलॉइड कहलाते हैं।
प्राकृतिक रूप से पाए जाने वाले वृहदाण्विक कोलॉइडों के उदाहरण हैं-स्टार्च, सेलुलोस प्रोटीन और इन्जाइम एवं मानव निर्मित वृहदाणु हैं-पॉलीथीन, नायलोन, पॉल स्टायरीन, संश्लेषित रबर आदि। सहचारी कोलॉइड एवं बहुअणुक तथा वृहदाणुक कोलॉइडों में अन्तर – बहुअणुक कोलॉइड सरल अणुओं; जैसे-S8 की अत्यधिक संख्या के पुन्जित होने पर बनते हैं। वृहदाणुक कोलॉइड अपने अणुओं के वृहद आकार के कारण कोलॉइडी सीमा में होता है; जैसे-स्टार्च।
कुद पदार्थ ऐसे होते हैं जो कम सान्द्रताओं पर सामान्य प्रबल विद्युतअपघट्य के समान व्यवहार करते हैं परन्तु उच्च सान्द्रताओं पर कणों का पुंज बनने के कारण कोलॉइड के समान व्यवहार करते हैं। इस प्रकार पुंजित कण मिसेल कहलाते हैं। ये सहचारी कोलॉइड भी कहलाते हैं। मिसेल केवल एक निश्चित ताप से अधिक ताप पर बनते हैं जिसे क्राफ्ट ताप कहते हैं, एवं सान्द्रता एक निश्चित सान्द्रता से अधिक होती है, जिसे क्रान्तिक मिसेल सान्द्रता (CMC) कहते हैं।
तनु करने पर ये कोलॉइड पुनः अलग-अलग आयनों में टूट जाते हैं। पृष्ठ सक्रिय अभिकर्मक जैसे साबुन एवं संश्लेषित परिमार्जक इसी वर्ग में आते हैं। साबुनों के लिए CMC का मान 10-4 से 10-3 mol L-1 होता है। इन कोलॉइडों में द्रवविरागी एवं द्रवरागी दोनों ही भाग होते हैं। मिसेल में 100 या उससे अधिक अणु हो सकते हैं।
![]()
प्रश्न 5.13
एन्जाइम क्या होते हैं? एन्जाइम उत्प्रेरण की क्रिया विधि को संक्षेप में लिखिए।
उत्तर:
एन्जाइम (Enzyme):
एन्जाइम जटिल नाइट्रोजनी कार्बनिक यौगिक होते हैं जो जीवित पौधों एवं जन्तुओं द्वारा उत्पन्न किए जाते हैं। वास्तविक रूप से ये उच्च आण्विक द्रव्यमान वाले प्रोटीन झुण हैं, जो जल में कोलॉइडी विलयन बनाते हैं। ये बहुत प्रभावी उत्प्रेरक होते हैं जो अनेक विशेष रूप से प्राकृतिक प्रक्रमों से सम्बद्ध अभिक्रियाओं को प्रेरित करते हैं। इन्वर्टेज, जाइमेज, डायस्टेन, माल्टेज एन्जाइमों के कुछ विशिष्ट उदाहरण हैं।
एन्जाइम उत्प्रेरण की क्रियाविधि:
एन्जाइम के कोलॉइडी कणों की सतहों पर बहुत सारे कोटर होते हैं। ये कोटर अभिलक्षणिक आकृति के होते हैं तथा इनमें सक्रिय समूह जैसे – NH2, – COOH – SH, – OH आदि होते हैं। वास्तव में यह स्तर पर उपस्थित सक्रिय केन्द्र (active centres) होते हैं। अभिकारक के अणु जिनकी परिपूरक आकृति होती है, इन कोटरों में एक ताले में चाबी के समान फिट हो जाते हैं। सक्रिय समूहों की उपस्थिति के कारण एक सक्रियित संकुल बनता है जो विघटित होकर उत्पाद देता है।
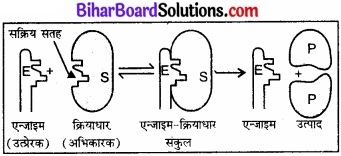
चित्र-एन्जाइम उत्प्रेरित अभिक्रियाओं की क्रियाविधि इस प्रकार, एन्जाइम उत्प्रेरित अभिक्रियाओं का दो पदों में सम्पन्न होना माना जा सकता है।
E + S R [E – S] → E + P
पद 1:
सक्रियित संकुलन बनाने के लिए एन्जाइम का सबस्ट्रेट से आबन्ध।
E + S → ES
पद 2:
उत्पाद बनाने के लिए सक्रियित संकुल का विघटन
E – S → E + P
![]()
प्रश्न 5.14
कोलॉइडों को निम्न आधार पर कैसे वर्गीकृत किया गया है:
(क) घटकों की भौतिक अवस्था।
(ख) परिक्षेपण माध्यम की प्रकृति।
(ग) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया।
उत्तर:
(क) घटकों की भौतिक अवस्था:
इसके लिए उपर्युक्त प्रश्न देखें।
(ख) परिक्षेपण माध्यम की प्रकृति:
यदि परिक्षेपण माध्यम जल है तो इन्हें एक्वासॉल या हाइड्रासॉल कहते हैं। यदि परिक्षेपण माध्यम ऐल्कोहॉल है, तो ये ऐल्कोसॉल कहलाते हैं। परिक्षेपण माध्यम बेन्जीन होने से बेन्जोसॉल कहलाते हैं तथा परिक्षेपण माध्यम वायु होने पर ये ऐरोसॉल कहलाते हैं।
(ग) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया:
परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया के आधार पर कोलॉइडी सॉल को दो वर्गों में विभाजित किया जा सकता है-द्रवरागी (विलायक को आकर्षित करने वाले) एवं द्रवविरागी (विलायक को प्रतिकर्षित करने वाले)। यदि परिक्षेपण माध्यम जल हो तो इन्हें क्रमश: जलरागी एवं जलविरागी कहा जाता है।
प्रश्न 5.15
निम्नलिखित परिस्थितियों में क्या प्रेक्षण होंगे:
- जब प्रकाश किरण पुंज कोलॉइडी सॉल में से गमन करता है।
- जलयोजित फेरिक ऑक्साइड सॉल में NaCl विद्युत अपघट्य मिलाया जाता है।
- कोलॉइडी सॉल में से विद्युतधारा प्रवाहित की जाती है।
उत्तर:
- जब प्रकाश किरण पुंज कोलॉइडी सॉल में से गमन करता है तो टिण्डल प्रभाव के कारण कोलॉइडी कणों द्वारा प्रकाश का प्रकीर्णन हो जाता है तथा प्रकाश का मार्ग प्रदीप्त हो जाता है।
- जब जलयोजित फेरिक ऑक्साइड सॉल में NaCl विद्युत अपघट्य मिलाया जाता है तो फेरिक ऑक्साइड के धनावेशित कोलॉइडी कण NaCl द्वारा प्रदत्त ऋणावेशित Cl– आयनों द्वारा स्कन्दित हो जाते हैं।
- जब कोलॉइडी सॉल में से विद्युतधारा प्रवाहित की जाती है तो, कोलॉइडी कण विपरीत आवेशित इलेक्ट्रॉड की ओर गति करने से ये अपना आवेश खोकर स्कन्दित हो जाते हैं।
![]()
प्रश्न 5.16
इमल्शन क्या हैं? इनके विभिन्न प्रकार क्या हैं? प्रत्येक प्रकार का उदाहरण दीजिए।
उत्तर:
इमल्शन (पायस):
ये द्रव द्रव कोलॉइड निकाय हैं अर्थात् उनमें सूक्ष्म विभाजित द्रव की बूंदों का दूसरे द्रव में परिक्षेपण होता है। जब दो अमिश्रणीय या आंशिक मिश्रणीय द्रवों के मिश्रण को हिलाया जाता है, तो एक द्रव में दूसरे द्रव का अपरिष्कृत परिक्षेपण प्राप्त होता है, जिसे इमल्शन (पायस) कहते हैं। सामान्यतया दो द्रवों में से एक जल होता है। इमल्शन दो प्रकार के होते हैं:
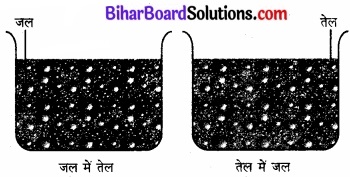
- तेल का जल में परिक्षेपण (o/w प्रकार)
- जल का तेल में परिक्षेपण (w/o प्रकार)
प्रथम निकाय में जल परिक्षेपण माध्यम की भांति कार्य करता है। इस प्रकार के इमल्शन के उदाहरण हैं-दूध एवं वैनीशिंग क्रम। दूध में, द्रव वसा जल में परिक्षिप्त होती है। दूसरे निकाय में, तेल परिक्षेपण माध्यम का कार्य करता है। इस प्रकार के सामान्य उदाहरण हैं-मक्खन एवं क्रीम।
प्रश्न 5.17
पायसीकर्मक पायस को स्थायित्व कैसे देते हैं ? दो पायसीकर्मकों के नाम लिखिए।
उत्तर:
अध्यापक की सहायता से करें।
![]()
प्रश्न 5.18
“साबुन की क्रिया पायसीकरण एवं मिसेल बनने के कारण होती है,” इस पर टिप्पणी लिखिए।
उत्तर:
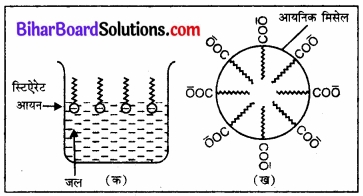
यह सत्य है कि साबुन की क्रिया पायसीकरण एवं मिसेल बनने के कारण होती है। इसे समझने के लिए हम साबुन के विलयन का उदाहरण लेते हैं। पानी में घुलनशील साबुन उच्च वसा अम्लों के सोडियम अथवा पोटैशियम लवण होते हैं जिन्हें RCOO– M+ द्वारा व्यक्त किया जा सकता है। उदाहरणार्थ, सोडियम स्टिऐरेट, जो साबुन का एक प्रमुख घटक है, जल मे विलीन करने पर C17H35COO– M+ एवं Na+ आयनों में विघटित हो जाता है।
किन्तु C17H35COO– आयन के दो भाग होते हैं – एक लम्बी हाइड्रोकार्बन श्रृंखला (जिसे ‘अध्रुवीय पुच्छ’ भी कहते हैं), जो जलविरागी (जल प्रतिकर्षी) होती है तथा ध्रुवीय समूह COO– (जिसे ‘ध्रुवीय आयनिक शीर्ष’ भी कहते हैं) जो जलरागी (जल को स्नेह करने वाला) होता है।
C17H35COO– आयन पृष्ठ पर इस प्रकार उपस्थित रहते हैं कि उनका COO– समूह जल में तथा हाइड्रोकार्बन श्रृंखला C7H35, पृष्ठ से दूर रहती है।
परन्तु क्रान्तिक मिसेल सान्द्रता पर ऋणायन विलयन के स्थूल में खिंच आते हैं एवं गोलीय आकार में इस प्रकार एकत्रित हो जाते हैं कि इनकी हाइड्रोकार्बन श्रृंखलाएँ गोले के केन्द्र की ओर इंगित होती हैं तथा COO– भाग गोले के पृष्ठ पर रहता है। इस प्रकार बना पुंज आयनिक मिसेल (Ionic Micelle) कहलाता है। इन मिसेलों में इस प्रकार के 100 तक आयन हो सकते हैं।

चित्र – स्टिऐरेट आयन के जलरागी एवं जलविरागी भाग
इस प्रकार अपमार्जकों जैसे सोडियम सल्फेट, CH3 (CH2)11 SO4– Na+ में लम्बी हाइड्रोकार्बन श्रृंखला सहित – SO4– ध्रुवीय समूह है, अत: मिसेल बनने की क्रियाविधि साबुनों वे समान ही है।
चित्र – (क) साबुन की निम्न सान्द्रता पर, जल के पृष्ठ पर स्टिऐरेट आयनों की व्यवस्था
(ख) साबुन की क्रान्तिक मिसेल सान्द्रता पर जल के आन्तरिक स्थूल में स्टिऐरेट आयनों की व्यवस्था (आयनिक मिसेल)।

चित्र – (क) कपड़े पर ग्रीस।
(ख) ग्रीस बूंदों के चारों ओर व्यवस्थित स्टिऐरेट आयन।
(ग) स्टिऐरेट आयनों द्वारा घिरी ग्रीस की बूंदें (बनी हुई मिसेल)
साबुन की शोधन-क्रिया इस तथ्य पर आधारित है कि साबुन के अणु तेल की बूंदों के चारों ओर इस प्रकार से मिसेल बनाते हैं कि स्टिऐरेट आयन का जलविरागी भाग बूंदों के अन्दर होता है तथा जलरागी भाग चिकनाई की बूंदों के बाहर काँटों की तरह निकलता रहता है।
चूंकि ध्रुवीय समूह जल से अन्योन्यक्रिया कर सकते हैं, अत: स्टिऐरेट आयनों से घिरी हुई तेल की बूंदें जल में खिंच जाती हैं एवं गन्दी सतह से हट जाती हैं। इस प्रकार साबुन तेलों तथा वसाओं का पायसीकरण (Emulsification) करके धुलाई में सहायता करता है। छोटी गोलियों के चारों ओर का ऋण आवेशित आवरण उन्हें एक साथ आकर पुंज बनाने से रोकता है।
![]()
प्रश्न 5.19
विषमांगी उत्प्रेरण के चार उदाहरण दीजिए।
उत्तर:
विषमांगी उत्प्रेरण के चार उदाहरण निम्नलिखित है –
1. हेबर प्रक्रम में सूक्ष्म विभाजित लोहे की उपस्थिति में अमोनिया बनने में डाइनाइट्रोजन एवं डाइहाइड्रोजन के मध्य संयोजन:

यहाँ अभिकारक गैसीय प्रावस्था में हैं जबकि उत्प्रेरक ठोस प्रावस्था में है।
2. ओस्टवाल्ड प्रक्रम में, प्लेटिनम गेज की उपस्थिति में, अमनोनिया का नाइट्रिक ऑक्साइड में ऑक्सीकरण –

3. Pt की उपस्थिति में सल्फर डाइऑक्साइड का सल्फर ट्राइऑक्साइड में ऑसीकरण –

यहाँ अभिकारक गैसीय प्रावस्था में हैं जबकि उत्प्रेरक ठोस अवस्था में हैं।
4. सूक्ष्म विभाजित निकैल उत्प्रेरक की उपस्थिति में वनस्पति तेलों का हाइड्रोजनीकरण –
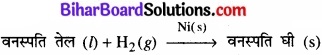
यहाँ अभिकारकों में से एक द्रव प्रावस्था में है जबकि दूसरा गैसीय प्रावस्था में है और उत्प्रेरक ठोस प्रावस्था में है।
![]()
प्रश्न 5.20
उत्प्रेरक की सक्रियता एवं वरणक्षमता का क्या अर्थ है?
उत्तर:
उत्प्रेरक की सक्रियता-उत्प्रेरक की किसी अभिक्रिया के वेग को बढ़ाने की क्षमता, उत्प्रेरकीय सक्रियता कहलाती है।
उदाहरणार्थ –
H2(g) + \(\frac{1}{2}\)O2(g) → कोई अभिक्रिया नहीं
H2(g) + \(\frac{1}{2}\)O2(g) + [Pt] → H2O(l) + [Pt] [विस्फोट के साथ तीव्र अभिक्रिया होती है।]
बहुत सीमा तक एक उत्प्रेरक की सक्रियता रसोवशोषण की प्रबलता पर निर्भर करती है। सक्रिय होने के लिए अभिकारक, उत्प्रेरक पर पर्याप्त प्रबलता से अधिशोषित होने चाहिएँ। यद्यपि वे इतनी प्रबलता से अधिशोषित नहीं होने चाहिएँ कि वे गतिहीन हो जाएँ एवं अन्य अभिकारकों के लिए उत्प्रेरक की सतह पर कोई स्थान रिक्त न रहे।
उत्प्रेरक की वरणक्षमता:
किसी उत्प्रेरक की वरणात्मकता उसकी किसी अभिक्रिया को दिशा देकर एक विशेष उत्पाद बनाने की क्षमता है। उदाहरणार्थ – H2 एवं CO से प्रारम्भ करके एवं भिन्न उत्प्रेरकों के प्रयोग से हम भिन्न-भिन्न उत्पाद प्राप्त कर सकते हैं।

इसी प्रकार एथेनॉल का विहाइड्रोजनीकरण तथा निर्जलीकरण दोनों सम्भव हैं। परन्तु उचित उत्प्रेरक की उपस्थिति में केवल एक अभिक्रिया ही होती है।
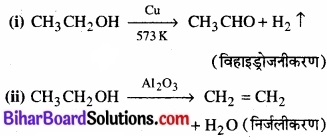
अतः यह निष्कर्ष निकाला जा सकता है कि, उत्प्रेरक के कार्य की प्रकृति अत्यधिक विशिष्ट होती है, अर्थात् कोई पदार्थ एक विशेष अभिक्रिया के लिए ही उत्प्रेरक हो सकता है, सभी अभिक्रियाओं के लिए नहीं। इसका अर्थ यह है कि एक पदार्थ एक अभिक्रिया में उत्प्रेरक का कार्य करता है, अन्य अभिक्रियाओं को उत्प्रेरित करने में असमर्थ हो सकता है।\
![]()
प्रश्न 5.21
जिओलाइटों द्वारा उत्प्रेरण के कुछ लक्षणों का वर्णन कीजिए।
उत्तर:
जिओलाइटों द्वारा उत्प्रेरण के लक्षण (Features of Catalysis by Zeolites):
1. जिओलाइट जलयोजित ऐलमिनो-सिलिकेट होते हैं, जिनकी त्रिविमीय नेटवर्क संरचना होती है तथा इनके सरन्ध्रों में जल-अणु निहित होते हैं।
2. जिओलाइटों को उत्प्रेरक के रूप में प्रयुक्त करने के लिए, इन्हें गर्म किया जाता है, जिससे सरन्ध्र उपस्थित जलयोजन का जल निकल जाता है तथा सरन्ध्र रिक्त हो जाते हैं।
3. सरन्ध्रों का आकार 260 से 740 pm के मध्य होता है; अतः केवल वे अणु ही इन सरन्ध्रों अधिशोषित हो पाते हैं जिनका आकार सरन्ध्रों में प्रवेश करने हेतु पर्याप्त रूप से कम होता है। इसीलिए आण्विक जाल (molecular sieves) या आकृति वरणात्मक उत्प्रेरक (Shape selective catalyst) की भाँति कार्य करते हैं।
4. जिओलाइट पेट्रोरसायन उद्योग में हाइड्रोकार्बनों के भंजन एवं समावयवन में उत्प्रेरक के रूप में व्यापक रूप में प्रयुक्त किए जा रहे हैं। ZSM-6 पेट्रोलियम उद्योग में प्रयुक्त होने वाला एक महत्त्वपूर्ण जिओलाइट उत्प्रेरक है। यह ऐल्कोहॉल का निर्जीलकरण करके हाइड्रोकार्बनों का मिश्रण बनता है और उसे सीधे ही गैसोलीन (पेट्रोल) में परिवर्तित कर देता है।

जहाँ x, 5 से 10 के मध्य परिवर्तित होता है। ZSM – 5 का falfalfa 778 “Zeolite Sieve of Molecular Porosity – 5″ हैं।
![]()
प्रश्न 5.22
आकृति वरणात्मक उत्प्रेरण क्या है?
उत्तरः
आकृति वरणात्मक उत्प्रेरण:
वह उत्प्रेरकी अभिक्रिया जो उत्प्रेरक की रंध्र संरचना एवं अभिकारक एवं उत्पाद अणुओं के आकार पर निर्भर करती है, आकार वरणात्मक उत्प्रेरक कहलाती है। एक आकृति वरणात्मक उत्प्रेरक में विभिन्न संरचना तथा आकार के सक्रिय स्थलों की बहुतायत संख्या होती है।
मधु-छत्तों जैसी संरचना के कारण जिओलाइट अच्छे आकृति-वरणात्मक उत्प्रेरक हैं। ये सिलिकेटस के त्रिविमीय नेटवर्क वाले सूक्ष्मरंध्री ऐलुमिनो सिलीकेट होते हैं, जिनमें कुछ सिलिकन परमाणु ऐलुमिनियम के परमाणुओं द्वारा प्रतिस्थापित होकर Al – O – Si ढाँचा बनाते हैं।
जिओलाइट के क्रिस्टल में सरन्ध्र आकार सामान्यतया 260 pm से 740 pm के मध्य होता है। ज़िओलाइट में होने वाली अभिक्रियाएँ अभिकारक तथा उत्पाद अणुओं के आकार एवं आकृति के साथ-साथ ज़िओलाइटों के सरन्ध्रों एवं कोटरों (Cavities) पर निर्भर करती हैं।
यदि अभिकारक अणुओं का आकार बहुत बड़ा होगा तो वे ज़िओलाइट के सरन्ध्रों में व्यवस्थित नहीं हो पाएँगें तथा अभिक्रिया नहीं होगी। दूसरी ओर यदि अभिकारक अणु अत्यन्त छोटे होंगे तो ये उत्प्रेरक के सन्ध्रों से फिसल जाएँगे तता कोई अन्योन्यक्रिया नहीं होगी। ZSM – 5 पेट्रोलियम उद्योग में प्रयुक्त होने वाला एक महत्त्वपूर्ण जिओलाइट उत्प्रेरक है। यह ऐल्कोहॉल का निर्जलीकरण करके हाइड्रोकार्बनों का मिश्रण बनता है और उन्हें सीधे ही गैसोलीन पेट्रोल में परिवर्तित कर देता है।
प्रश्न 5.23
निम्नलिखित पदों (शब्दों) को समझाइए –
- विद्युत कण-संचलन
- स्कन्दन
- अपोहन
- टिण्डल प्रभाव।
उत्तर:
1. विद्युत कण-संचलन (Elec – trophoresis):
कोलॉडडी कणों पर धनात्मक या ऋणात्मक आवेश होता है, जिससे ये कण विद्युत प्रभाव क्षेत्र में विपरीत आवेशित इलेक्ट्रोड की ओर अभिगमन करते हैं। विद्युत क्षेत्र में कोलॉइडी कणों के विपरीत आवेशित इलेक्ट्रोड की ओर अभिगमन (migration) की घटना को विद्युत कण-संचलन कहते हैं।
कोलॉइडी कणों की कैथोड की ओर की गति को धन कण-संचलन (cataphoresis) तथा ऐनोड की ओर की गति को ऋण कण संचलन (anaphoresis) कहते हैं; जैसे-फेरिक हाइड्रॉक्साइड सॉल के कोलॉइडी कण धनावेशित होते हैं और ये ग्रेड की ओर गति करते हैं।

चित्र – विद्युत-कण संचालन
इसकी सहायता से कोलॉइडी विलयनों में कोलॉइडी कणों पर का अध्ययन किया जाता है।
2. स्कन्दन (Coagulation):
किसी कोलॉइडी विलयन अर्थात् सॉल को स्थायी बनाने के लिए अल्प-मात्रा में विद्युतअपघट्य मिलाना आवश्यक होता है, परन्तु विद्युत-अपघट्य की अधिक मात्रा कोलॉइडी विलयन का अवक्षेपण कर देती है। कोलॉइड विलयनों को विद्युत- अपघट्य के विलयनों द्वारा अवक्षेपित करने की क्रिया को स्कन्दन कहते हैं।
इस क्रिया में कोलॉइडी कणों की सतह पर विद्युत-अपघट्य से उनकी प्रकृति के विपरीत आवेशित आयन अधिशोषित हो जाता है जिससे उनका आकार बढ़ जाता है, फलस्वरूप वे अवक्षेपित (स्कन्दित) हो जाते हैं; जैसे – As2S3 सॉल में विद्युत-अपघट्य BaCl2 डालने पर, As2S3 स्कन्दित (अपेक्षित) हो जाता है; क्योंकि विद्युत-अपघट्य (BaCl2 ⇄ Ba2++ + 2Cl–) के Ba2+ आयन As2S3 के ऋणात्मक आवेश को उदासीन कर देता है, फलस्वरूप उनका आकार बढ़ जाता है और वह आपेक्षित हो जाता है।
3. अपोहन (Dialysis):
यह विधि इस तथ्य आधारित है कि घुलित पदार्थों के अणु व आयन चर्म-पत्र झिल्ली (parchment paper) में से सरलतापूर्वक विसरित हो जाते हैं, जबकि कोलॉइडी कण में से विसरित नहीं हो पाते या कठिनाई से विसरित हो जाते हैं। चर्म-पत्र झिल्ली द्वारा कोलॉइडी विलयन में घुलित पदार्थों को पृथक् करने की विधि को अपोहन (dialysis) कहते हैं।
चर्म-पत्र झिल्ली से बनी एक थैली या किसी बेलनाकार पात्र, जिसे अपोहक (dialyser) कहते हैं, कोलॉइडी विलयन भरकर उसे बहते हुए जल में निलम्बित करते हैं।
कोलॉइडी विलयन में उपस्थित घुलित पदार्थ के कण झिल्ली में से होकर बहते हुए जल के साथ बाहर निकल जाते हैं। कुछ दिनों में शुद्ध कोलॉइडी विलयन प्राप्त हो जाता है। अपोहन की दर को बढ़ाने के लिए विद्युत क्षेत्र भी प्रयुक्त किया जाता है जिसे विद्युत-अपोहन (electrodialysis) कहते हैं। अत: कोलॉइडी विलयनों के शोधन हेतु अपोहन विधि से प्रयुक्त करते हैं।

चित्र – अपोहन
4. टिण्डन प्रभाव (Tyndall effect):
जिस प्रकार अँधेरे कमरे में प्रकाश की किरण में धूल के कण चमकते हुए दिखाई पड़ते हैं, उसी प्रकार लेन्सों से केन्द्रित प्रकाश को कोलॉइडी विलयन में डालकर समकोण दिशा में रखे एक सूक्ष्मदर्शी से देखने पर कोलॉइडी कण अँधेरे में घूमते हुए दिखाई देते हैं। इस घटना के आधार पर वैज्ञानिक टिण्डल ने कोलॉइडी
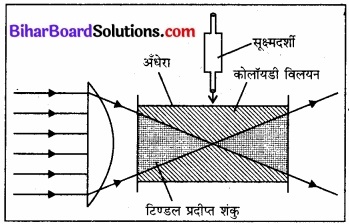
विलयनों में एक प्रभाव का अध्ययन किया जिसे टिण्डन प्रभाव कहा गया; अतः कोलॉइडी कणों द्वारा प्रकाश के प्रकीर्णन (scattering of light) के कारण टिण्डल प्रभाव होता है।
कोलॉइडी कणों का आकार प्रकाश की तरंगदैर्घ्य (wavelength of light) से कम होता है; अतः प्रकाश की किरणों के कोलॉइडी कणों पर पड़ने पर कण प्रकाश की ऊर्जा का अवशोषण करके स्वयं आत्मदीप्त (self-illuminated) हो जाते हैं। अवशोषित ऊर्जा के पुनः छोटी तरंगों के प्रकाश के रूप में प्रकीर्णित होने से नीले रंग का एक शंकु दिखता है, जिसे टिण्डल शंकु (Tyndall cone) कहते हैं और यह टिण्डल घटना कहलाती है।
![]()
प्रश्न 5.24
इमल्शनों (पायस) के चार उपयोग लिखिए।
उत्तर:
इमल्शनों (पायस) के चार उपयोग –
- सल्फाइड अयस्क का फेन प्लवन प्रक्रम द्वारा सान्द्रण इमल्सीफिकेशन पर आधारित होता है।
- दूध-जल में वसा का इमल्शन होता है।
- साबुन तथा डिटर्जेन्ट की शोधन क्रिया गन्दगी तथा साबुन के विलयन के मध्य इमल्शन पर आधारित है।
- विभिन्न सौन्दर्य प्रसाधन; जैसे – क्रीम, शैम्पू आदि अनेक औषधियाँ तथा लेप आदि इमल्शन हैं जो कि इमल्शन के रूप में अधिक प्रभावी होते हैं।
प्रश्न 5.25
मिसेल क्या है? मिसेल निकाय का एक उदाहरण दीजिए।
उत्तर:
मिसेल (Micelles):
कुछ पदार्थ ऐसे होते हैं, जो कम सान्द्रताओं पर सामान्य प्रबल वैद्युत-अपघट्यों के समान व्यवहार करते हैं परन्तु उच्च सान्द्रताओं पर कणों का पुन्ज बनने के कारण कोलॉइड के समान व्यवहार करते हैं। इस प्रकार के पुन्जित कण मिसेल कहलाते हैं। मिसेल को सहचारी कोलॉइड भी कहते हैं। जल में साबुन का सान्द्र विलयन एक मिसेल निकाय है।
![]()
प्रश्न 5.26
निम्नलिखित पदों को उदाहरण सहित समझाइए:
- ऐल्कोसॉल
- ऐरीसॉल
- हाइड्रोसॉल।
उत्तर:
- ऐल्कोसॉल: वे कोलॉइड जिसमें परिक्षेपण माध्यम ऐल्कोहॉल हो, ऐल्कोसॉल कहलाता है। उदाहरणएथिल ऐल्कोहॉल में सेलुलोस नाइट्रेट का कोलॉइडी सॉल (कोलोडियन)।
- ऐरोसॉल: वे कोलॉइड जिसमें परिक्षेपण मध्यम वायु या गैस हो, ऐरोसॉल कहलाता है। उदाहरण-कोहरा।
- हाइड्रोसॉल: वह कोलॉइड जिसमें परिक्षेपण माध्यम जल हो हाइड्रोसॉल कहलाता है। उदाहरण-स्टार्च सॉल।
प्रश्न 5.27
“कोलॉइड एक पदार्थ नहीं, पदार्थ की एक अवस्था है।” इस कथन पर टिप्पणी कीजिए।
उत्तर:
कुछ निश्चित परिस्थितियों के अन्तर्गत एक पदार्थ कोलॉइड के रूप में पाया जाता है तथा वही पदार्थ अन्य निश्चित परिस्थितियों के अन्तर्गत क्रिस्टलीय रूप में भी पाया जा सकता है। जैसे – जल में NaCl क्रिस्टल की भांति व्यवहार करता है तथा बेन्जीन में, यह कोलॉइड की भांति व्यवहार करता है। अतः दिया गया कथन सत्य है।