Bihar Board Class 12 Chemistry Solutions Chapter 6 तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम Textbook Questions and Answers, Additional Important Questions, Notes.
BSEB Bihar Board Class 12 Chemistry Solutions Chapter 6 तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम
Bihar Board Class 12 Chemistry तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम Text Book Questions and Answers
पाठ्यनिहित प्रश्न एवं उनके उत्तर
प्रश्न 6.1
पाठ्यपुस्तक की सारणी 6.1 में दर्शाए गए अयस्कों में से कौन-से चुम्बकीय पृथक्करण विधि द्वारा सान्द्रित किए जा सकते हैं?
उत्तर:
यदि अयस्क या गैंग (दोनों में से एक) चुम्बकीय हो उन्हें चुम्बकीय प्रथक्करण विधि द्वारा किया जा सकता है। सारणी में दर्शाए गये अयस्क जैसे-हेमेटाइट (Fe2O3), मेग्नेटाइट (Fe3O4) सिडेराइट (FeCO3) तथा आयरन पाइराइट (FeS2) को चुम्बकीय पृथक्करण विधि द्वारा सान्द्रित किया जा सकता है।
प्रश्न 6.2
ऐलुमिनियम के निष्कर्षण में निक्षालन का क्या महत्त्व है?
उत्तर:
ऐलुमिनियम के मुख्य अयस्क बाक्साइट में मुख्यत: SiO2, आयरन ऑक्साइड आदि की अशुद्धियाँ होती हैं जिन्हें ऐलुमिनियम के निष्कर्षण में निक्षालन द्वारा हटाया जा सकता है तथा शुद्ध ऐलुमिना भी प्राप्त किया जा सकता है।
![]()
प्रश्न 6.3
अभिक्रिया Cr2O3 + 2Al → Al2O3 + 2Cr (∆G° = – 421 kJ) के गिब्ज ऊर्जा मान से लगता है कि अभिक्रिया ऊष्मागतिकी के अनुसार सम्भव है, पर यह कक्ष ताप पर सम्पन्न क्यों नहीं होती?
उत्तर:
चूँकि संक्रियण ऊर्जा की निश्चित मात्रा ऊष्मा गतिकीय अभिक्रियाओं के लिए आवश्यक होती है, अतः दी गई अभिक्रिया को सम्पन्न करने के लिए अतिरिक्त ऊष्मा की आवश्यकता होती है।
प्रश्न 6.4
क्या यह सत्य है कि कुछ विशिष्ट परिस्थितियों में मैग्नीशियम, Al2O3 को अपचित कर सकता है और Al, Mgo को? वे परिस्थितियाँ कौन-सी है?
उत्तर:
अध्यापक की सहायता से करें।
Bihar Board Class 12 Chemistry तत्त्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम Additional Important Questions and Answers
अभ्यास के प्रश्न एवं उनके उत्तर
प्रश्न 6.1
कॉपर का निष्कर्षण हाइड्रोधातुकर्म द्वारा किया जाता है, परन्तु जिंक का नहीं। व्याख्या कीजिए।
उत्तर:
जिंक का मानक इलेक्ट्रोड विभव (EΘ) [Zn2+ | Zn = – 0.76 V] कॉपर व EΘ | Cu2+ | Cu = + 0.34] से कम होता है। दूसरी ओर जिंक Cu2+ आयनों के विलयन से Cu को विस्थापित कर सकता है।
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
इसीलिए Zn2+ आयनों के विलयन से जिंक विस्थापित करने के लिए हमें इससे अधिक क्रियाशील धातु की आवश्यकता होगी अर्थात्

परन्तु ये सभी धातुएँ जल से क्रिया करके अपने सम्बन्धित आयन बनाती हैं तथा H2 गैस मुक्त करती है। इसलिए Al, Mg आदि को Zn2+ आयनों के विलयन से जिंक विस्थापित करने में प्रयुक्त नहीं किया जा सकता। अतः कॉपर का निष्कर्षण हाइड्रोधातुकर्म द्वारा किया जा सकता है, परन्तु जिंक का नहीं।
![]()
प्रश्न 6.2
फेन प्लवन विधि में अवनमक की क्या भूमिका है?
उत्तर:
फेन प्लावन विधि में, अवनमक की भूमिका दो सल्फाइड अयस्कों को पृथक् करना होता है। उदाहरणार्थ: एक अयस्क में से जिंक सल्फाइड (ZnS) तथा लेड सल्फाइड को पृथक करने के लिए सोडियम साइनाइड (NaCN) प्रयुक्त किया जाता है। इस चयन से ZnS को फेन में आने से रोकता है परन्तु Pbs को फेन में आने देता है। अत: ZnS अयस्क से पृथक किया जा सकता है।
प्रश्न 6.3
अपचयन द्वारा आक्साइड अयस्कों की अपेक्षा पाइराइट से ताँबे का निष्कर्षण अधिक कठिन क्यों है?
उत्तर:
Cu2S के निर्माण की मानक मुक्त ऊर्जा (∆fGΘ); CS2 तथा H2S की मानक मुक्त ऊर्जा की तुलना में अधिक होती है। इसलिए कार्बन तथा हाइड्रोजन Cu2S को Cu में अपचयित नहीं कर सकते हैं।
Cu2S + H2 → 2Cu ↓+ H2S ↑
2Cu2S + C → 4Cu ↓+ CS2
दूसरी ओर Cu2O का ∆fGΘ CO2 की तुलना में अत्यन्त कम होता है, इसलिए कार्बन सरलता से Cu2O को Cu में अपचयित कर सकता है।
Cu2O(s) + C(s) → 2Cu(s) + CO(g)
इसी कारण अपचयन द्वारा ऑक्साइड अयस्कों की अपेक्षा पाइराइट से ताँबे का निष्कर्षण अधिक कठिन है।
![]()
प्रश्न 6.4
व्याख्या कीजिए –
- मण्डल परिष्करण
- स्तम्भ वर्णलेखिकी।
उत्तर:
1. मण्डल परिष्करण (Zone Refining):
यह विधि इस सिद्धान्त पर आधारित है कि अशुद्धियों की विलेयता धातु की ठोस अवस्था की अपेक्षा गलित अवस्था में अधिक होती है। अशुद्ध धातु की छड़ के एक किनारे पर एक वृत्ताकार गतिशील तापक लगा रहता है (चित्र)।
इसकी सहायता अशुद्ध धातु को गर्म किया जाता है। तापक जैसे ही आगे की ओर बढ़ता है, गलित से शुद्ध धातु क्रिस्टलित हो जाती है तथा अशुद्धियाँ संलग्न गलित मण्डल में चली जाती हैं।
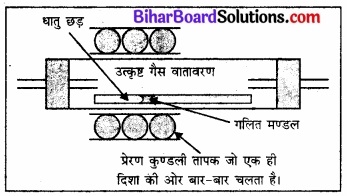
चित्र – मण्डल परिष्करण प्रक्रम
इस क्रिया को कई बार दोहराया जाता है तथा तापक को एक ही दिशा में बार-बार चलाते हैं। अशुद्धियाँ छड़ के एक किनारे पर एकत्रित हो जाती हैं। इसे काटकर अलग कर लिया जाता है। यह विधि मुख्य रूप से अतिउच्च शुद्धता वाले अर्धचालकों तथा अन्य अतिशुद्ध धातुओं; जैसे-जर्मेनियम, सिलिकॉन, बोरॉन, गैलियम तथा इंडियम को प्राप्त करने के लिए बहुत उपयोगी है।
2. स्तम्भ वर्णलेखिकी (Column Chromatography):
यह विधि इस सिद्धान्त पर आधारित है कि अधिशोषक पर मिश्रण के विभिन्न घटकों का अधिशोषण अलग-अलग होता है। मिश्रण को द्रव या गैसीय माध्यम में रखा जाता है जो कि अधिशोषक में से गुजरता है। स्तम्भ में विभिन्न घटक भिन्न-भिन्न स्तरों पर अधिशोषित हो जाते हैं। बाद में अधिशोषित घटक उपर्युक्त विलायकों (निक्षालक) द्वारा निक्षालित कर लिए जाते हैं। गतिशील माध्यम की भौतिक
अवस्था, अधिशोषक पदार्थ की प्रकृति एवं गतिशील माध्यम के गमन के प्रक्रम पर भी निर्भर होने के कारण इसे ‘स्तम्भ वर्णलेखिकी’ नाम दिया जाता है। इस प्रकार की एक विधि में कांच की नली में Al2O3 का एक स्तम्भ बनाया जाता है तथा गतिशील माध्यम जिसमें अवयवों का विलयन उपस्थित होता है, द्रव प्रावस्था में होता है।
यह स्तम्भ-वर्णलेखिकी का एक उदाहरण है। यह सूक्ष्म मात्रा में पाए जाने वाले शुद्धिकरण और शुद्ध किए जाने वाले तत्व तथा अशुद्धियों के रासायनिक गुणों में अधिक भिन्नता न होने की स्थिति में, शुद्धिकरण के लिए अत्यधिक उपयोगी होती है। स्तम्भ वर्णलेखिकी में प्रयुक्त प्रक्रम में चित्र में दर्शाया गया है।
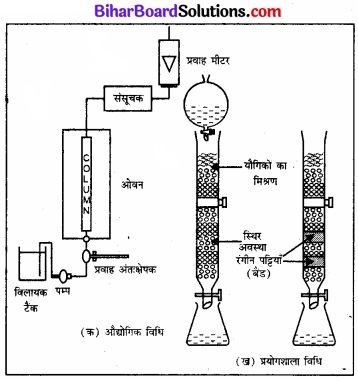
चित्र-स्तम्भ वर्णलेखिकी
![]()
प्रश्न 6.5
673 K ताप पर C तथा CO में से कौन-सा अच्छा अपचायक है?
उत्तर:
जब कार्बन डाइआक्सीजन से अभिक्रिया करता है, तब दो अभिक्रियाँ सम्भव होती हैं –
C(s) + O2 (g) → CO2 (g)
2C(s) + O2 (g) → 2CO (g) प्रथम अभिक्रिया में उत्पन्न CO2 का आयतन, प्रयुक्त O2 के आयतन के बराबर होता है, इसलिए ∆S अत्यन्त कम होता है तथा ∆G ताप के साथ परिवर्तित नहीं होता है। अतः ∆G तथा T के मध्य ग्राफ लगभग क्षैतिज होता है। द्वितीय अभिक्रिया प्रयुक्त O2 के प्रत्येक एक आयतन के लिए CO के दो आयतन उत्पन्न करती है।
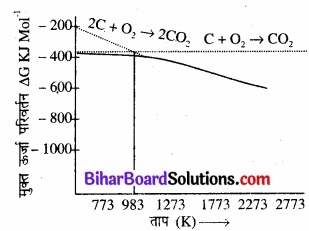
चित्र-कार्बन के लिए एर्लिंघम आरेख
अतः ∆S धनात्मक होता है तथा ∆G ताप बढ़ाने पर ऋणात्मक रूप से बढ़ता है। परिणामस्वरूप एलिंघम आरेख पर इसकी रेखा का ढाल नीचे की ओर होता है। अभिक्रियाओं C → CO2 तथा C → CO के लिए दोनों रेखाएँ 983 K पर एक-दूसरे को काटती हैं।
इस ताप से नीचे CO2 का निर्माण करने वाली अभिक्रिया ऊष्मीय रूप से अधिक सम्भव होगी, परन्तु 673 K से अधिक ताप पर CO का निर्माण होगा। दूसरे शब्दों में 673 K से नीचे ताप पर C तथा CO दोनों अपचायक की भाँति कार्य करते हैं ‘क्योंकि CO का CO2 में आक्सीकरण C → CO2 की अपेक्षा सरलता से हो सकता है, इसलिए 673 K से ताप पर CO कार्बन की अपेक्षा अधिक प्रभावी अपचायक होता है।
![]()
प्रश्न 6.6
कॉपर के विद्युत-अपघट्न शोधन में ऐनोड पंक में उपस्थित सामान्य तत्वों के नाम दीजिए। वे वहाँ कैसे उपस्थित होते हैं?
उत्तर:
कॉपर के विद्युत अपघट्न शोधन में ऐनोड पंक में उपस्थित सामान्य तत्व ऐन्टीमनी, सेलेनियम, सिल्वर, गोल्ड आदि (CuSO4 + H2SO4) हैं। ये तत्व, कम क्रियाशील होते हैं जिससे ये विलयन द्वारा प्रभावित नहीं होते और ऐनोड पर ऐनोड पंक के रूप में विद्यमान रहते हैं।
प्रश्न 6.7
आयरन (लोहे) के निष्कर्षण के दौरान वात्या भट्टी के विभिन्न क्षेत्रों में होने वाली अभिक्रियाओं को लिखिए।
उत्तर:
वात्या भट्टी मे विभिन्न ताप-परासों में आयरन ऑक्साइड का अपचयन होता है। वात्या भट्टी में होने वाली अभिक्रियाएँ निम्नलिखित हैं –
500 – 800K पर (वात्या भट्टी में निम्न ताप परिसर में)
3Fe2O3 + CO → 2Fe3O4 + CO2↑
Fe3O4 + 4CO → 3Fe ↓+ 4CO2 ↑
Fe2O3 + CO → 2FeO + CO2 ↑
900 – 1500K पर (वात्या भट्टी में उच्च ताप-परिसर में)
C + CO2 → 2CO ↑
FeO + CO → Fe ↓+ CO2 ↑
चूना पत्थर (लाइमस्टोन) भी CaO में अपघटित हो जाता है जो अयस्क की सिलिकेट अशुद्धि को धातुमल के रूप में हटा देता है। धातुमल स्लैग गलित अवस्था में हो जाता है तथा आयरन से पृथक्कृत हो जाता है।
![]()
प्रश्न 6.8
जिंक ब्लेण्ड से जिंक के निष्कर्षण में होने वाली रासायनिक अभिक्रियाओं को लिखिए।
उत्तर:
जिंक ब्लेण्ड से जिंक के निष्कर्षण में होने वाली रासायनिक अभिक्रियाएँ निम्नलिखित हैं –
1. सान्द्रण (Concentration):
अयस्क का सान्द्रण फेन प्लावन प्रक्रम द्वारा किया जाता है।
2. भर्जन (Roasting):
सान्द्रित अयस्क को लगभग 1200K ताप पर वायु की अधिकता में भर्जन किया जाता है जिससे जिंक ऑक्साइड प्राप्त होता है।

3. अपचयन (Reduction):
प्राप्त जिंक ऑक्साइड को चूर्णित कोक के साथ मिलाकर एक फायर क्ले रिटॉर्ट में 1673K तक गर्म करने पर जिंक धातु में अपचयित हो जाता है।

4. विद्यत-अपघटनी शोधन (Electrolytic refining):
अशुद्ध जिंक ऐनोड तथा कैथोड शुद्ध जिंक कैथोड लेते हैं। इसमें विद्युत-अपघट्य तनु H2SO4 से अम्लीकृत ZnSO4 विलयन लेकर विद्युत धारा प्रवाहित करने पर शुद्ध Zn कैथोड पर प्राप्त हो जाता है।
![]()
प्रश्न 6.9
कॉपर के धातुकर्म में सिलिका की भूमिका बताइए।
उत्तर:
भर्जन के दौरान, कॉपर पाइराइट FeO तथा Cu2O के मिश्रण में परिवर्तित हो जाते हैं।

2FeS + 3O2 → 2FeO + 2SO2
FeO तथा कॉपर, कॉपर मेट के रूप में प्राप्त होता है इसमें Cu2S तथा Fes होते हैं। FeO, SiO2 से संयोग करके फेरस सिलिकेट (FeSiO3) धातुमल बनाता है जो गलित अवस्था में मैट पर तैरता है।
प्रश्न 6.10
‘वर्णलेखिकी’ पद का क्या अर्थ है?
उत्तर:
वर्णलेखिकी (Chromatography) को मूल रूप में ग्रीक शब्द Chroma अर्थात् रंग या वर्ण तथा graphy अर्थात् लेखन है। किसी मिश्रण के कुछ या सभी अवयवों को भिन्न प्रावस्थाओं में पृथक करने के प्रक्रम को वर्णलेखिकी कहते हैं। यह विधि किसी मिश्रण के अवयवों के दो प्रावस्थाओं के मध्य वर्णात्मक वितरण पर आधारित है। इस में एक अवस्था स्थिर अवस्था ठोस या द्रव होती है और दूसरी प्रावस्था गतिमान प्रावस्था द्रव या गैस होती है।
प्रश्न 6.11
वर्णलेखिकी में स्थिर प्रावस्था के चयन में क्या मापदण्ड अपनाए जाते हैं?
उत्तर:
स्थिर प्रावस्था का चयन के लिए अशुद्धियाँ स्थिर प्रावस्था में शुद्ध होने वाले तत्व से अधिक विलेय हो। जब स्तम्भ का निष्कर्षण किया जाता है, तब अशुद्धियाँ स्थिर प्रावस्था द्वारा रुक जाती है तथा शुद्ध घटक को सरलतापूर्वक हटा देते हैं।
![]()
प्रश्न 6.12
निकिल-शोधन की विधि समझाइए।
उत्तर:
निकिल शोधन की मॉन्ड प्रक्रम:
इस प्रक्रम में निकिल को कार्बन मोनोक्साइड के प्रवाह में गरम करने से वाष्पसील निकिल टेट्राकार्बोनिल संकुल बन जाता है –

इस कार्बोनिल को और अधिक ताप पर गरम करते हैं, जिससे यह विघटित होकर शुद्ध धातु दे देता है।

प्रश्न 6.13
सिलिकायुक्त बॉक्साइट अयस्क में से सिलिका को ऐलुमिना से कैसे अलग करते हैं? यदि कोई समीकरण हो तो दीजिए।
उत्तर:
सिलिकायुक्त बॉक्साइट अयस्क को NaOH के सान्द्रविलयन के साथ 473 – 523K ताप पर तथा 35-36 bar दाब पर गर्म करते हैं। इससे, ऐलुमिना, सोडियम ऐलुमिनेट के रूप में तथा सिलिका, सोडियम सिलिकेट के रूप में घुल जाती है तथा अशुद्धियाँ अवशेष के रूप में रह जाती हैं।

सोडियम सिलिकेट परिणामी विलयन को छानकर अविलेय अशुद्धियों (यदि कोई हो) को हटा दिया जाता है तथा इसे CO2 गैस प्रवाहित करके उदासीन कर दिया जाता है। इस अवस्था पर विलयन को ताजा बने हुए जलयोजित Al2O3 के नमूने से बीजरोपित किया जाता है, जो अवक्षेपण को प्रेरित करता है।

सोडियम सिलिकेट विलयन में शेष रह जाता है तथा जलयोजित ऐलुमिना को छानकर, सुखाकर तथा गर्म करके पुनः शुद्ध Al2O3 प्राप्त कर लिया जाता है।

![]()
प्रश्न 6.14
उदाहरण देते हुए भर्जन एवं निस्तापन में अन्तर बताइए।
उत्तर:
निस्तापन (Calcination):
इस क्रिया में सांद्रित अयस्क को इतना गर्म करते हैं कि वह पिघले नहीं। इस क्रिया में अयस्क से गैसीय पदार्थ अथवा वाष्पशील पदार्थ अलग हो जाते हैं। गैस निकलने से अयस्क सरन्ध्र हो जाते हैं।
कार्बोनेट अयस्क अपघटित हो आक्साइड में बदल जाते हैं तथा CO2 निकल जाती है।
CaCO3 + CaO + CO2
ZnCO3 → ZnO + CO2
भर्जन (Roasting):
इस क्रिया में अयस्क को वायु की उपस्थिति में उसके गलनांक से नीचे गर्म किया जाता है। भर्जन क्रिया के द्वारा अयस्क आंशिक या पूर्ण रूप से आक्सीकृत हो जाता है। यहाँ S, As आदि अशुद्धियाँ ऑक्साइड के रूप में निकल जाती हैं तथा अयस्क ऑक्साइड में परिवर्तित हो जाते हैं। जैसे-जिंक ब्लैड (ZnS) के भर्जन पर ZnO प्राप्त होता है।
2ZnS + 3O2 → 2ZnO + 2SO2
भर्जन एवं निस्तापन में अन्तर (Difference between Roasting and Calcination):
निस्तापन तथा भर्जन लगभग समान क्रियाएँ होती हैं। भर्जन में अयस्क को अकेले अथवा किसी अन्य पदार्थ के साथ गर्म करते हैं, जबकि निस्तापन अयस्क को अकेले ही गर्म करते हैं। भर्जन में As, Sb, S आदि की अशुद्धियाँ आक्साइड बनकर बाहर निकल जाती हैं, जबकि निस्तापन में H2O तथा CO2 आदि बाहर निकल जाते हैं।
![]()
प्रश्न 6.15
ढलवाँ लोहा कच्चे लोहे से किस प्रकार भिन्न होता है?
उत्तर:
वात्या भट्टी से प्राप्त लोहे में लगभग 4% कार्बन तथा अन्य अशुद्धियाँ; जैसे – S, P, Si, Mn सूक्ष्म मात्रा में उपस्थित रहती है। यह कच्चे लोहे (pig iron) के नाम से जाना जाता है तथा विभिन्न आकृतियों में ढाला जा सकता है। ढलवाँ लोहा (cast iron) कच्चे लोहे से भिन्न होता है तथा इसे कच्चे लोहे को, रद्दी लोहे एवं कोक के साथ गर्म हवा के झोंकों द्वारा पिघलाकर बनाया जाता है। इसमें थोड़ा कम कार्बन (लगभग 3%) होता है तथा यह अति कठोर और भंगुर होता है।
प्रश्न 6.16
अयस्कों तथा खनिजों में अन्तर स्पष्ट कीजिए।
उत्तर:
खनिज (minerals):
प्रकृति में पाए जाने वाले धातु के विभिन्न खनिज कहलाते हैं, जैसे – एक सॉल्ट (NaCl)
अयस्क (Ores):
वे खनिज जिसे शद्ध धातु का निष्कर्षण अधिक मात्रा में कम व्यय पर सुविधा से किया जा सकता है, अयस्क कहलाते हैं। जैसे – बॉक्साइट (Al2O3.2H2O) एल्युमीनियम का अयस्क है। अतः सभी अयस्क खनिज होते हैं, परन्तु सभी खनिज अयस्क नहीं होते हैं।
प्रश्न 6.17
कॉपर मैट को सिलिका की परत चढ़े हुए परिवर्तकों में क्यों रखा जाता है?
उत्तर:
कॉपर मैट में Cu2S तथा FeS से जब कॉपर मैट को सिलिका की परत चढ़े हुए परिवर्तक में लेकर इसमें गर्म वायु का तेज झोंका प्रवाहित करते हैं तब मैट में उपस्थित FeS फेरिक ऑक्साइड ऑक्सीकृत हो जाता है और सिलिका से क्रिया कर FeSiO2 धातुमल बनाता है।

जब धातुमल (FeSiO3) को अलग कर लिया जाता है तो Cu2S ऑक्सीकृत होकर Cu2O बनाता है जो Cu2S के संयोग से कॉपर धातु देता है।
2Cu2S + 3O2 → 2Cu2O + 2SO2
2Cu2O + Cu2S → 6Cu + SO2
अतः कॉपर के निष्कर्षण में सिलिका की भूमिका धातुमल को हटाने की होती है।
![]()
प्रश्न 6.18
ऐलुमिनियम के धातुकर्म में क्रायोलाइट की क्या भूमिका है?
उत्तर:
यह ऐलुमिना के गलनांक को कम करता है और उसकी विद्युत चालकता को बढ़ाता है।
प्रश्न 6.19
निम्न कोटि के कॉपर अयस्कों के लिए निक्षालन क्रिया को कैसे किया जाता है?
उत्तर:
निम्न कोटि के कॉपर अयस्कों से कॉपर का निष्कर्षण हाइड्रोधातु कर्म द्वारा करते हैं। इसे अम्ल या जीवाणु के उपयोग से निक्षालित करते हैं तथा Cu2+ आयन युक्त विलयन H2 से क्रिया करते हैं।
Cu2+ (aq) + H2 (g) → Cu(s) + 2H+ (aq)
प्रश्न 6.20
CO के उपयोग करते हुए अपचयन द्वारा जिंक ऑक्साइड से जिंक का निष्कर्षण क्यों नहीं किया जाता?
उत्तर:
चूंकि CO से CO2 के निर्माण की मानक मुक्त ऊर्जा (∆fGΘ), Zn से Zn0 के निर्माण की मानक ऊर्जा अधिक होने के कारण Zno को Zn में अपचयित करने के लिए CO का उपयोग नहीं किया जा सकता है।
![]()
प्रश्न 6.21
Cr2O3 के विरचन के लिए ∆fGΘ का मान – 540 kJ mol-1 है तथा Al2O3 के लिए – 827 kJ mol-1 है। क्या Cr2O3 का अपचयन Al से सम्भव है?
गणना:
इस प्रक्रम में अभिक्रियाओं के दो समीकरण है –

समीकरण (1) को (2) में से घटाने पर,
\(\frac{4}{3}\) cr(s) – \(\frac{4}{3}\) Al(s) → \(\frac{2}{3}\) Cr2O3 (s) – \(\frac{2}{3}\) Al2O3(s);
\(\frac{4}{3}\) Al (s) + \(\frac{2}{3}\) Cr2O3 (s) → \(\frac{2}{3}\) Al2O3 (s) + \(\frac{4}{3}\) Cr (s); ∆fGΘ = -287 kJ mol-1
∵ संयुक्त रेडॉक्स अभिक्रिया का ∆fGΘ ऋणात्मक है।
∴ Cr2O3 का अपचयन Al से सम्भव है।
प्रश्न 6.22
C व CO में से Zno के लिए कौन-सा अपचायक अच्छा है?
उत्तर:
जिंक ऑक्साइड का अपचयन कोक द्वारा किया जाता है। इसमें कॉपर की स्थिति की अपेक्षा ताप अधिक रखा जाता है। तापन के लिए ऑक्साइड की कोक तथा मृदा के साथ छोटी-छोटी ईटें बनाई जाती हैं।

धातु को आसवित कर तथा तीव्र शीतलन द्वारा एकत्र कर लेते हैं। C से CO के निर्माण की मुक्त ऊर्जा (∆fGΘ) 1120K से अधिक ताप पर कम हो जाती है, जबकि O से CO2 के निर्माण की मुक्त ऊर्जा, Zn0 के AG° की तुलना में, 1323 K से अधिक ताप पर कम हो 1120 K से अधिक ताप पर C से CO के बनने में मुक्त ऊर्जा कम हो जाती है।
जबकि 1323 K से अधिक ताप पर C से CO2 के बनने में मुक्त ऊर्जा, ZnO की मुक्त ऊर्जा की तुलना में कम हो जाती है। चूंकि CO से CO2 की मुक्त ऊर्जा ZnO से अधिक होती है, अत: C, ZnO का Zn में अपचयन कर सकता है जबकि CO नहीं। अत: c व CO में से ZnO के लिए अच्छा अपचायक C है, जबकि CO नहीं।
![]()
प्रश्न 6.23
किसी विशेष स्थिति में अपचायक का चयन ऊष्मागतिकी कारकों पर आधारित है। आप इस कथन से कहाँ तक सहमत हैं? अपने मत के समर्थन में दो उदाहरण दीजिए।
उत्तर:
किसी निश्चित धात्विक ऑक्साइड का धात्विक अवस्था में अपचयन करने के लिए उचित अपचायक का चयन करने में ऊष्मागतिकी कारक सहायता करता है। इसे निम्नवत् समझा जा सकता है –
ऐलिंघम आरेख से यह स्पष्ट होता है कि वे धातुएँ, जिनके लिए उनके ऑक्साइडों के निर्माण की मानक ऊर्जा अधिक ऋणात्मक होती है, उन धातु ऑक्साइडों को अपचयित कर सकती है जिनके लिए उनके सम्बन्धित ऑक्साइडों के निर्माण की मानक मुक्त ऊर्जा कम ऋणात्मक होती है। दूसरे शब्दों में कोई धातु किसी धातु के ऑक्साइड को केवल तब अपचयित कर सकती है, जबकि यह एलिंघम आरेख में इस धातु से नीचे स्थित हो।
चूँकि संयुक्त रेडॉक्स अभिक्रिया का मानक मुक्त ऊर्जा परिवर्तन ऋणात्मक होगा (जोकि दोनों धातु आक्साइडों के ∆fGΘ में अन्तर के तुल्य होता है।); अत: Al तथा Zn दोनों FeO को Fe में अपचयित कर सकते हैं, परन्तु Fe, Al2O3, को Al में तथा ZnO को Zn में अपचयित नहीं कर सकता। इसी प्रकार C, ZNO को Zn में अपचयित कर सकता है, परन्तु CO को नहीं।
प्रश्न 6.24
उस विधि का नाम लिखिए जिसमें क्लोरीन सहउत्पाद के रूप में प्राप्त होती है। क्या होगा यदि NaCl के जलीय विलयन का विद्युत अपघटन किया जाए?
उत्तर:
सोडियम धातु डॉउन प्रक्रम द्वारा प्राप्त की जा सकती है। इस प्रक्रम में NaCl तथा CaCl2 के संगलित मिश्रण का 873K पर विद्युत अपघटन किया जाता है। जिससे सोडियम कैथोड पर निरावेशित होती है तथा Cl2 ऐनोड पर सहउत्पाद के रूपं में होती है।

यदि NaCl के जलीय विलयन का विद्युत अपघटन किया जाता है तो कैथोड पर H2 मुक्त होती है तथा Cl2 ऐनोड पर प्राप्त होती है। चूँकि Na+/ Na रेडॉक्स युग्म का E°(= – 2.17 V) जल के E° (= – 0.83 V) की अपेक्षा कम होता है तथा अत: जल Na+ आयनों की अपेक्षा H2 में अपचयित हो जाता है।

![]()
प्रश्न 6.25
ऐलुमिनियम के विद्युत-धातुकर्म में ग्रेफाइट छड़ की क्या भूमिका है?
उत्तर:
इस धातु में Al2O3 में Na3AlF6 या CaF2 मिलाया जाता है जिससे मिश्रण का कम हो जाता है और इसमें चालकता आ जाती है। विद्युत-अपघटन में ग्रेफाइट के रूप में विद्युत अपघटन तथा स्टील कैथोड के रूप में प्रयुक्त होते हैं। विद्युत-अपघट्य में Al कैथोड पर और CO तथा CO2 ऐनोड पर बनती है।
कथोड:
Al3+ (गलित) → Al(l)
ऐनोड:
C(s) + O2-(गलित) → CO(g) + 2e–
C(s) + 2O2- (गलित) → CO2(g) + 4e–
ग्रेफाइट के स्थान पर किसी अन्य धातु लेने पर मुक्त ऑक्सीजन न केवल इलेक्ट्रोड की धातु को ऑक्सीकृत करेगी बल्कि कैथोड पर मुक्त Al की कुछ मात्रा को Al2O3 में परिवर्तित कर देगी। अत: Al के निष्कर्षण में ग्रेफाइट की भूमि का ऐनोड पर 0, को संरक्षित करके मुक्त होने वाले Al की कुछ मात्रा को पुन: Al2O3 में परिवर्तन न करने में रोकना होती है।
प्रश्न 6.26
निम्नलिखित विधियों द्वारा धातुओं के शोधन के सिद्धान्तों की रूपरेखा दीजिए:
- मण्डल परिष्करण
- विद्युतअपघट्न परिष्करण
- वाष्य प्रावस्था परिष्करण
उत्तर:
1. मण्डल परिष्करण:
मण्डल परिष्करण (Zone Refining):
यह विधि इस सिद्धान्त पर आधारित है कि अशुद्धियों की विलेयता धातु की ठोस अवस्था की अपेक्षा गलित अवस्था में अधिक होती है। अशुद्ध धातु की छड़ के एक किनारे पर एक वृत्ताकार गतिशील तापक लगा रहता है (चित्र)।
इसकी सहायता अशुद्ध धातु को गर्म किया जाता है। तापक जैसे ही आगे की ओर बढ़ता है, गलित से शुद्ध धातु क्रिस्टलित हो जाती है तथा अशुद्धियाँ संलग्न गलित मण्डल में चली जाती हैं।

चित्र – मण्डल परिष्करण प्रक्रम
इस क्रिया को कई बार दोहराया जाता है तथा तापक को एक ही दिशा में बार-बार चलाते हैं। अशुद्धियाँ छड़ के एक किनारे पर एकत्रित हो जाती हैं। इसे काटकर अलग कर लिया जाता है। यह विधि मुख्य रूप से अतिउच्च शुद्धता वाले अर्धचालकों तथा अन्य अतिशुद्ध धातुओं; जैसे-जर्मेनियम, सिलिकॉन, बोरॉन, गैलियम तथा इंडियम को प्राप्त करने के लिए बहुत उपयोगी है।
2. विधुतअपघटन परिष्करण:
इस विधि में अशुद्ध धातु की ऐनोड बनाते हैं। उसी धातु की शुद्ध धातु-पट्टी को कैथोड के रूप में प्रयुक्त करते हैं। इन्हें एक उपयुक्त विद्युतअपघटनी विश्लेषित्र में रखते हैं जिसमें उसी धातु का लवण घुला रहता है। अधिक क्षारकीय धातु विलयन में रहती है तथा कम क्षारकीय धातुएँ ऐनोड पंक (anode mud) में चली जाती हैं। इस प्रक्रम की व्याख्या, विद्युत विभव की धारण, अधिविभव तथा गिब्ज के द्वारा (उपयोग) भी की जा सकती है। ये अभिक्रियाएँ निम्नलिखित हैं –
ऐनोड: Mn → Mn+ + ne–
कैथोड: Cu2+ + 2e– → Cu
फफोलेदार कॉपर से अशुद्धियाँ ऐनोड पंक के रूप में जमा होती हैं, जिसमें एण्टिमनी सेलीनियम टेल्यूरियम, चाँदी, सोना तथा प्लैटिनम मुख्य होती हैं। इन तत्वों की पुनः प्राप्ति से शोधन की लागत की क्षतिपूर्ति हो सकती है। जिंक का शोधन भी इसी प्रकार से किया जा सकता है।
3. वाष्प प्रावस्था परिष्करण-इस विधि में, धातु को वाष्पशील यौगिक में परिवर्तित किया जाता है तथा दूसरे स्थल पर एकत्र कर लेते हैं। इसके बाद इसे विघटित करके शुद्ध धातु प्राप्त कर लेते हैं। इस प्रक्रिया की दो आवश्यकताएँ होती हैं –
(क) उपलब्ध अभिकर्मक के साथ धातु वाष्पशील यौगिक बनाती हो तथा
(ख) वाष्पशील पदार्थ आसानी से विघटित हो सकता हो, जिससे धातु आसानी से पुनः प्राप्त की जा सके।
उदाहरणार्थ:
जर्कोनियम या टाइटेनियम शोधन के लिए वॉन-आरकैल विधि – यह Zr तथा Ti जैसी कुछ धातुओं से अशुद्धियों की तरह उपस्थित सम्पूर्ण ऑक्सीजन तथा नाइट्रोजन को हटाने में बहुत उपयोगी है। परिष्कृत धातु को निर्वातित पात्र में आयोडीन के साथ गर्म करते हैं। धातु आयोडाइड अधिक सहसंयोजी होने के कारण वाष्पीकृत हो जाता है।
Zr + 2I2 → ZrI4
धातु आयोडाइड को विद्युत धारा द्वारा 1800K ताप पर गर्म किए गए टंगस्टन तन्तु पर विघटित किया जाता है। इस प्रकार से शुद्ध धातु तन्तु पर जमा हो जाती है।
ZrI4 → Zr + 2I2 ↑
![]()
प्रश्न 6.27
उन परिस्थितियों का अनुमान लगाइए जिनमें Al, MgO को अपचयित कर सकता है।
उत्तर:
इसके लिए रासायनिक अभिक्रियाएँ निम्नवत् हैं –
\(\frac{4}{3}\) Al + O2 → \(\frac{2}{3}\) Al2O3; ∆fGΘ Al, Al2O3 ……………….. (1)
2 Mg + O2 → 2MgO; ∆fGΘ Mg, MgO ………………. (2)
एलिंघम आरेख द्वारा स्पष्टीकरण:
कुछ ऑक्साइडों के विरचन में T तथा ∆GΘ के एलिंघम आरेख निम्न प्रकार से हैं –
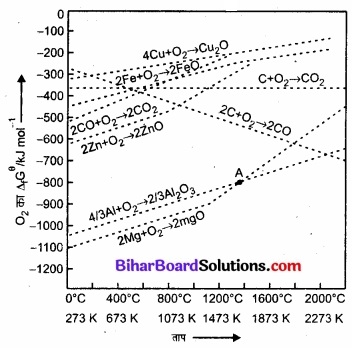
कुछ ऑक्साइडों के विरचन में गिब्ज ऊर्जा ∆GΘ तथा ताप T के मध्य वक्र (आरेखीय एलिंघम आलेख)।
उपर्युक्त आरेख से 1665K से नीचे तापमान पर Al2O3 का ∆fGΘ मान MgO की अपेक्षा कम ऋणात्मक है। अतः जब समीकरण (1) को समीकरण (2) में से घटाने पर संयुक्त रेडॉक्स अभिक्रियाओं ∆fGΘ ऋणात्मक होता है। 2Mg + \(\frac{2}{3}\) Al2O3 → 2MgO + \(\frac{4}{3}\)Al
∆fGΘ = ऋणात्मक …………….. (3)
अतः 1665K से नीचे तापमान पर Mg Al2O3 को Al में अपचयित कर सकता है। 1665K से अधिक तापमान पर Al2O3 का मान MgO की तुलना में अधिक ऋणात्मक होता है। अत: जब समीकरण (2) को समीकरण (1) में से घटाने पर संयुक्त रेडॉक्स अभिक्रिया अर्थात् समीकरण (4) का ∆fGΘ ऋणात्मक होता है।
\(\frac{4}{3}\) Al + 2MgO → \(\frac{2}{3}\) Al2O3 + 2Mg;
∆fGΘ = ऋणात्मक ……………………. (4)
अतः 1665K से अधिक तापमान पर Al MgO को Mg में अपचयित कर सकता है।