BSEB Bihar Board 12th Chemistry Important Questions Long Answer Type Part 3 are the best resource for students which helps in revision.
Bihar Board 12th Chemistry Important Questions Long Answer Type Part 3
प्रश्न 1.
How acetaldehyde is prepared in laboratory ? How does it react with (a) Cl2 (b) NaHSO3 (c) Ammonia (d) PCl5 (e) C2H5OH (f) Ammonical silver nitrate (g) Fehling solution (h) NaOH (i) HCN
(प्रयोगशाला में ऐसीटल्डिहाइड कैसे बनाया जाता है? यह निम्न के साथ किस प्रकार प्रतिक्रिया करता है ? (a) क्लोरीन (b) सोडियम बाइसल्फाइट (c) अमोनिया (d) PCl5 (e) इथाइल एल्कोहॉल (f) अमोनिकल सिल्वर नाइट्रेट (g) फेहलिंग घोल (h) NaOH (i) HCN
उत्तर:
इथाइल एल्कोहल को अम्लीय पोटैशियम डाइक्रोमेट के द्वारा ऑक्सीकरण करके ऐसीटल्डिहाइड बनाया जाता है। पोटैशियम डाइक्रोमेट घोल को तनु गन्धकाम्ल के द्वारा अम्लीय बनाया जाता है।
K2Kr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 4H2O + 3[O]
CH3.CH2OH + O → CH3CHO + H2O
अम्लीय K2Cr2O7 घोल और इथाइल एल्कोहल के मिश्रण का स्रवण करने पर ऐसीटल्डिहाइड स्रवित द्रव के रूप में प्राप्त होता है इस प्रकार से प्राप्त ऐसीटल्डिहाइड में इथाइल एल्कोहल एवं जल भी रहते हैं। इन्हें दूर करने के लिए प्राप्त ऐसीटल्डिहाइड को निर्जल CaCl2 के साथ स्रवणे. किया जाता है। स्रावित द्रव को जमा कर उसमें अमोनिया गैस प्रवाहित की जाती है जिसके फलस्वरूप ऐसीटल्डिहाइड अमोनिया के श्वेत रवे प्राप्त होता है। इन रवों को सल्फ्यूरिक अम्ल के साथ स्रावित कर शुद्ध ऐसीटल्डिाइड प्राप्त किया जाता है।
(a) क्लोरीन के साथ प्रतिक्रिया : ऐसीटल्डिहाइड क्लोरीन के साथ प्रतिक्रिया कर ट्राइक्लोरो ऐसीटल्डिहाइड बनाता है।
CH3CHO + 3Cl2 → CCl3CHO + 3HCl
(b) सोडियम बाइसल्फाइट के साथ प्रतिक्रिया : यह सोडियम बाइसल्फाइट के साथ प्रतिक्रिया कर योगशील यौगिक ऐसीटल्डिहाइड सोडियम बाइसल्फाइट के श्वेत रवे बनाता है।
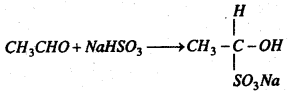
(c) अमोनिया के साथ प्रतिक्रिया : ऐसीटल्डिहाइड अमोनिया के साथ प्रतिक्रिया कर योगशील यौगिक ऐसीटल्डिहाइड अमोनिया बनाता है।
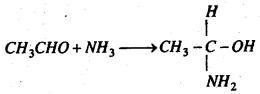
(d) PCl5 के साथ प्रतिक्रिया : फॉस्फोरस पेण्टाक्लोराइड के साथ ऐसीटल्डिहाइड प्रतिक्रिया कर इथिलीडीन क्लोराइड बनाता है।
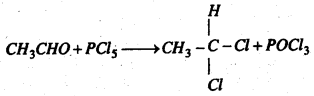
(e) इथाइल एल्कोहल के साथ प्रतिक्रिया : शुष्क HCl गैस की उपस्थिति में ऐसीटल्डिहाइड को इथाइल एल्कोहॉल के साथ गर्म करने पर ऐसीटल बनता है।

(f) अमोनिकल सिल्वर नाइट्रेट के साथ प्रतिक्रिया : अमोनिकल सिल्वर नाइट्रेट को पोपोटल्डिहाइड के साथ गर्म करने पर यह ऐसीटिक अम्ल में ऑक्सीकृत होता है तथा घोल से सिल्वर मुक्त हो जाता है।

(g) फेहलिंग घोल के साथ प्रतिक्रिया : ऐसीटल्डिहाइड को जब फेहलिंग घोल के साथ गर्म किया जाता है तो क्यूप्रस ऑक्साइड का लाल अवक्षेप बनता है।
![]()
(h) NaOH के साथ प्रतिक्रिया : तनु NaOH की उपस्थिति में ऐसीटल्डिहाइड के अणु आपस में संघनित होकर ऐल्डॉल बनाते हैं।
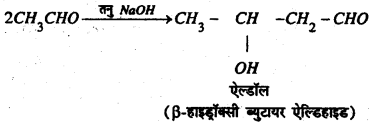
(i) हाइड्रोसायनिक अम्ल के साथ प्रतिक्रिया : ऐसीटल्डिहाइड हाइड्रोसायनिक अम्ल के साथ प्रतिक्रिया कर ऐसीटल्डिहाइड सायनोहाइड्रीन बनाता है।

प्रश्न 2.
प्रयोगशाला में ऐसीटोन कैसे बनाया जाता है ? यह निम्न से किस प्रकार प्रतिक्रिया करता है? (a) क्लोरीन (b) विरंजक चूर्ण एवं जल (c) NaOH एवं आयोडीन (d) सोडियम बाइसल्फाइट (e) फिनाइल हाइड्रॉजीन (f) हाइड्रॉजीन (g) हाइड्रॉक्सिल ऐमीन (h) PCl5 (i) हाइड्रोसायनिक अम्ल (j) HCl गैस (k) क्लोरोफॉर्म।
उत्तर:
प्रयोगशाला में निर्जल कैल्सियम ऐसीटेट का शुष्क स्रवण करके ऐसीटोन बनाया जाता है। कैल्सियम ऐसीटेट में थोड़ा लौह कतरन भी डाला जाता है जिससे कि सम्पूर्ण पदार्थ में समान रूप से ताप लगे। स्रवण के फलस्वरूप ऐसीटोन द्रव के रूप में जमा होता है जिसमें कुछ अशुद्धियाँ ![]()
अशुद्धियों को दूर करने के लिए इसमें सोडियम बाइसल्फाइट का संतृप्त घोल डाला जाता है जिससे ऐसीटोन सोडियम बाइसल्फाइट के श्वेत रवे प्राप्त होते हैं। इन रवों को छानकार सुखाने के बाद सोडियम कार्बोनेट के साथ स्रावित किया जाता है। स्रावित द्रव को पुनः निर्जल कैल्सियम क्लोराइड के साथ नावित किया जाता है जिससे शुद्ध ऐसीटोन प्राप्त होता है।
(a) क्लोरीन के साथ प्रतिक्रिया : ऐसीटोन की प्रतिक्रिया क्लोरीन के साथ कराने पर ट्राइक्लोरी ऐसीटोन बनता है।
CH3CO.CH3 +3Cl2 → CaCl3-CO-CH3 + 3HCl
(b) विरंजक चूर्ण एवं जल : ऐसीयेन को विरंजक चूर्ण एवं जल के साथ गर्म करने पर क्लोरोफार्म बनता है।
CH3COCH3 + Ca(OCl)Cl + H2O → CHCl3 + Ca(CH3COO)2
(c) आयोडीन एवं सोडियम हाइडॉक्साइड : ऐसीटोन को आयोडीन एवं सोडियम हाइड्रॉक्साइड के साथ गर्म करने पर आयोडोफॉर्म बनता है।
CH3COCH3 + 3I2 + 4NaOH → CHI3 + 3Nal + CH3COONa + 3H2O
(d) सोडियम बाइसल्फाइड : ऐसीटोन सोडियम बाइसल्फाइट के साथ प्रतिक्रिया कर ऐसीटोन सोडियम बाइसल्फाइट के रवे बनाता है।

(e) फिनाइल हाइड्रोजीन : ऐसीटोन फिनाइल हाइड्रोजीन बनाता है।
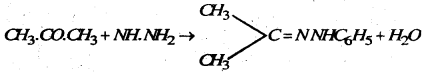
(f) हाइड्राजीन : ऐसीटोन हाइड्रोजीन के साथ प्रतिक्रिया कर ऐसीटोन हाइड्रोजीन बनाता है।

(g) हाइड्रॉक्सिल ऐमीन : ऐसीटोन हाइड्राक्सिल ऐमीन के साथ प्रतिक्रिया कर ऐसीटॉक्जिम बनाता है।
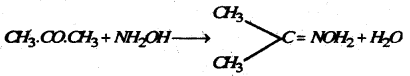
(h) FCl5 : फॉस्फोरस पेण्टाक्लोराइड के साथ प्रतिक्रिया कर यह 2, 2-डाइक्लोरोप्रोपेन बनाता है।
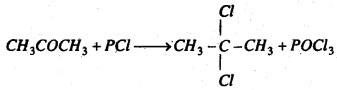
(i) हाइड्रोसायनिक अम्ल के साथ प्रतिक्रिया : ऐसीटोन हाइड्रोसायनिक अम्ल के साथ प्रतिक्रिया कर ऐसीटोन सायनोहाइड्रीन बनाता है।
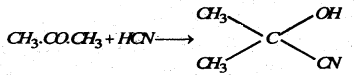
(j) HCl गैस : ऐसीटोन को HCl गैस से संतृप्त करने पर मेसिटायल ऑक्साइड एवं फोरोन बनते हैं।
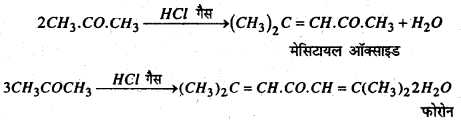
(K) बलोरोफॉर्म के साथ प्रतिक्रिया : KOH का उपस्थिति में ऐसीटोन क्लोरोफार्म के साथ प्रतिक्रिया कर क्लोरेटोन बनाता है।
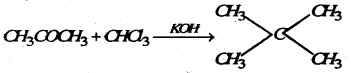
प्रश्न 3.
How ethyl amine is prepared in the laboratory. Describe its important properties.
(प्रयोगशाला में इथाइल ऐमीन कैसे बनाया जाता है ? इसके प्रमुख गुणों का वर्णन करें।)
उत्तर:
प्रयोगशाला में इथाइल ऐमीन हॉफमैन ब्रोम,माइड प्रतिक्रिया के द्वारा बनाया जाता है। कॉस्टिक क्षार की उपस्थिति में गर्म अवस्था में प्रोपायोनामाइड की प्रतिक्रिया ब्रोमीन के साथ कराने परं इथाइल ऐमीन बनता है। प्रतिक्रिया इस प्रकार होती है-
प्रोपायोनामाइड ब्रोमीन के साथ प्रतिक्रिया कर मोनो ब्रोमो प्रोपायोनामाइड बनाता है।
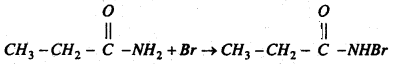
मोनोब्रोमो प्रोपायोनामाइड में समावयवी परिवर्तन होता है।
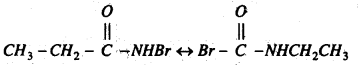
मोनोब्रोमो प्रोपायोनामाइड का समावयवी यौगिक एक अणु HBr मुक्त कर इथाइल आइसोसायनेट बनाता है।
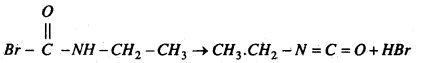
इथाइल आइसोसायनेट क्षार के साथ प्रतिक्रिया कर इथाइल ऐमीन बनाता है।
CH3.CH2.NCO + 2NaOH → CH3.CH2.NH2 + Na2CO3
प्रोपायोनामाइड, बोमीन एवं NaOH के मिश्रण को 70° C तक गर्म किया जाता है। गर्म तबतक किया जाता है जबतक कि मिश्रण रंगहीन न हो जाय। इस द्रव का स्रवण किया जाता है और सावित द्रव को तनु HCl में अवशोषित किया जाता है जिससे इथाइल ऐमीन हाइड्रोक्लोराइड बनता है। इथाइल ऐमीन हाइड्रोक्लोरोइड को NaOH के साथ नावित करने पर इथाइल ऐमीन प्राप्त होता है।
गुण : (i) जल के साथ प्रतिक्रिया : इथाइल ऐमीन जल में घुलकर इथाइल अमोनियम हाइड्रॉक्साइड बनाता है जिसमें प्रवल क्षारीय गुण होता है।
(ii) हैलोजन की प्रतिक्रिया : क्षार की उपस्थिति में इथाइल ऐमीन ब्रोमीन के साथ प्रतिक्रिया कर N-बोसोइथाइल ऐमीन एवं N-डाइब्रोमी इथाइल ऐमीन बनाता है।

(iii) नाइट्रस अम्ल की प्रतिक्रिया : इथाइल ऐमीन नाइट्रस अम्ल के साथ प्रतिक्रिया कर इथाइल एल्कोहल बनाता है।
CH3.CH2NH2 + HNO2 → CH3CH2OH + H2O + N2
(iv) क्लोरोफार्म के साथ प्रतिक्रिया : इथाइल ऐमीन को जब क्लोरोफॉर्म एवं KOH के । साथ गर्म किया जाता है तो इथाइल आइसोसायनाइड बनाता है।
CH3CH2NH2 + CHCl3 + 3KOH → CH3.CH2.N = +3KCl + 3H2O
(v) प्रिग्नाई प्रतिकारक के साथ प्रतिक्रिया : ग्रिग्नार्ड प्रतिकारक के साथ प्रतिक्रिया कर यह एल्केन बनाता है। ग्रिग्नार्ड प्रतिकारक का एल्काइल मूलक ही एल्केन में बदलता है।
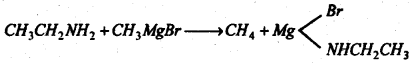
(vi) कार्बन डाइसल्फाइड के साथ प्रतिक्रिया : मरक्यूरिक क्लोराइड की उपस्थिति में .इथाइल ऐमीन को कार्बन डाइसल्फाइड के साथ गर्म करने पर इथाइल आइसोथायोसायनेट बनता है।
CH3.CH2NH2 + CS2 → CH3CH2N = C = S + H2S
(vii) एल्काइल हैलाइड के साथ प्रतिक्रिया : इथाइल ऐमीन इथाइल आयोडाइड के साथ प्रतिक्रिया कर क्रमशः डाइइथाइल ऐमीन, ट्राइइथाइल ऐमीन एवं टेट्राइथाइल अमोनियम आयोडाइड बनाता है।
CH3CH2NH2 + CH3CH3CH2I → (CH3CH2)2NH
(CH3CH2)2 NH + CHI3.CH2I → (CH3CH2)3N
(CH3CH2)3N + CH3.CH2I → (CH3CH2)4NI
प्रश्न 4.
ईथर क्या है ? ईथर (1) ऐल्काइल हैलाइड (2) एल्कोहॉल से कैसे प्राप्त किया जाता है ?
उत्तर:
(A) इंथर (Ethers)- ईथर एक ऐसा कार्बनिक यौगिक हैं जिनमें ऑक्सीजन के परमाणु से दो समान अथवा भिन्न एकाइल मूलक जुड़े रहते हैं। ईथर को जल का द्वि-ऐल्काइल व्युत्पन्न माना जाता है। जैसे-
R-O-R’ [जहाँ R = R’ अथवा R ≠ R’]
जब ऑक्सीजन परमाणु के दोनों ओर समान ऐल्काइल मूलक जुड़े रहते हैं, उसे सरल ईथर (simple ether) तथा असमान ऐल्काइल मूलक वाले ईथर मिश्रित ईथर (Mixed ether) कहलाते हैं। इसका सामान्य सूत्र CnH2n+2O है।
C2H5-O-C2H5
Diethy ether
(Simple ether)
CH3-O-C2H5
Ethyl methyl ether
(Mixed ether)
ईथर बनाने की विधियाँ-
(1) ऐल्काइल हैलाइड द्वारा-
(a) ऐल्काइल हैलाइड की प्रतिक्रिया शुष्क सिल्वर ऑक्साइड से कराने पर अल्पमात्रा में ईथर प्राप्त होता है।
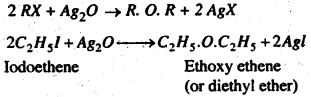
(b) ऐल्काइल हैलाइड की प्रतिक्रिया सोडियम या पोटाशियम ऐल्कॉक्साइड (Alkoxide) से कराने पर ईथर प्राप्त होता है। इस विधि को Williamson’s synthesis (विलियमसंस संश्लेषण) कहते हैं।

(2) एल्कोहॉल द्वारा :
(a) एल्कोहॉल अधिक मात्रा में लेकर इसे सान्द्र H2SO4 के साथ 413 K ताप तक गर्म करने पर ईथर प्राप्त होता है। इस विधि में दो अणु एल्कोहॉल से एक अणु जेल निकलता है तथा ईथर का निर्माण होता है। इसलिए इसे निर्जलीकरण विधि कहते हैं।
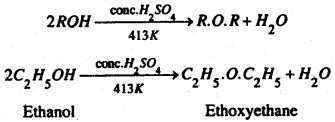
यह प्रतिक्रिया निम्न प्रकार दो चरणों में होती है :
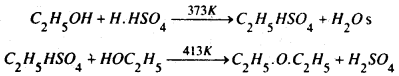
(b) एल्कोहलों के वाष्प को अधिक दाब पर 513 K तक गर्म ऐल्यूमिना (Al2O3) अथवा थोरिया (ThO2) जैसे उत्प्रेरकों पर प्रवाहित करने से ईथर बनता है।
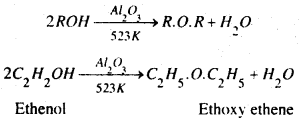
प्रश्न 5.
(a) प्रतिक्रिया का Molecularity एवं order में अन्तर स्पष्ट करें।
उत्तर:
प्रतिक्रिया का Molecularity एवं order में निम्न अन्तर है।
Molecularity (आणविकता):
- Reaction में भाग लेने वाले प्रतिकारका के कणों (परमाणु/अणु/आयन) की संख्या को Molecularity कहा जाता है।
- यह Theoretical facts पर आधारित होती है।
- इसका मान सदैव धनपूर्णांक संख्या होता है।
- यह ताप एवं सान्द्रण द्वारा अप्रभावित होती है।
Order (कोटि):
- Reaction के गति को निर्धारित करने वाले प्रतिकारकों के मोलर सान्द्रण के घातों का योगफल के प्रतिक्रिया को कोटि कहा जाता है।
- यह Experimental facts पर आधारित होती है।
- इसका मान शून्य भिन्न संख्या तथा पूर्णांक संख्या हो सकता है।
- यह ताप एवं सान्द्रण द्वारा प्रभावित होती है।
प्रश्न 5.
(b) Prove that the half life period of a first order reaction is Independent of the Initial concentration.
उत्तर:
First oder reaction के Rate constant expression से ज्ञात है कि
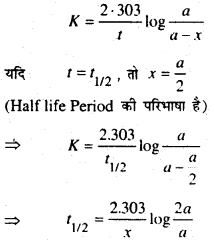
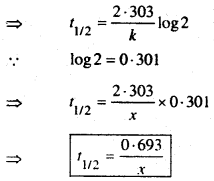
जहाँ T1/2 = First order Reaction का Half life Period प्राप्त व्यंजक से स्पष्ट है कि First order reaction का Half life period प्रतिकारक के प्रारम्भिक सान्द्रक पर निर्भर नहीं करती है।
प्रश्न 6.
What do you understand by adsorption? Distinguish between physical adsorption and chemical adsorption (chemisorption).
(अधिशोषण से आप क्या समझते हैं? भौतिक अधिशोषण एवं रासायनिक अधिशोषण में अन्तर बतावें ?)
उत्तर:
असंतुलित. अथवा अवशिष्ट आणविक बलों के कारण द्रव का पृष्ठ तनाव या असंतृप्ता की स्थिति में रहता है। उसी प्रकार ठोस पदार्थों के पृष्ठ पर भी असंतुलित अथवा : अवशिष्ठ बल रहते हैं जिसके कारण वे भी तनाव अथवा असंतृप्ता की स्थिति में रहते हैं। पृष्ठ पर उपस्थित अवशिष्ट बलों की असंतृप्ति के फलस्वरूप ठोस एवं द्रव पदार्थों के पृष्ठ में घुलित पदार्थों या गैसों को जिनके संपर्क में वे आते हैं अपनी ओर आकर्षित करके या अपने ऊपर धारण करने अपने अवशिष्ट बलों को संतुष्ट करने की प्रवृत्ति होती है। पृष्ठ पर केन्द्रीकरण की यह घटना अधिशोषण कहलाती है। इसमें ठोस एवं द्रव पदार्थों के पृष्ठ पर उपस्थित अवशिष्ट बलों, जिन्हें मुक्त संयोजकताएँ भी कहते हैं, को संतुष्ट करने के लिए घुलित पदार्थ या गैस के आणविक स्पीशिज ठोस एवं द्रव पदार्थों के सिर्फ पृष्ठ पर रहते हैं तथा उनके परिणाम के अन्दर की अपेक्षा पृष्ठ पर अणुओं का सान्द्रण अधिक होता है। इस तरह किसी आणविक स्पीशिज का ठोस या द्रव का परिणाम (पिण्ड) के अन्दर की अपेक्षा पृष्ठ पर उच्च सान्द्रण की घटना अधिशोषण कहलाती है। ठोस या द्रव पदार्थ जिनके पृष्ठ पर अधिशोषण होता है अधिशोषक कहलाते हैं तथा अधि शोषक के पृष्ठ पर अधिशोषित होने वाले पदार्थ अधिशोध्य कहलाते हैं। उदाहरणार्थ,
चॉक के एक टुकड़े को स्याही में डुबाने पर स्याही चॉक के पृष्ठ पर लग जाती है। चॉक के टुकड़े को तोड़कर देखने पर पता चलता है कि स्याही चॉक के टुकड़े के केवल पृष्ठ पर लग पायी है, उसके परिमाण के अन्दर प्रवेश नहीं कर पायी है।
चारकोल के पृष्ठ पर एसीटिक अम्ल और आयोडीन भी अधिशोषित हो जाते हैं।
अधिशोषण एक पृष्ठयी घटना है। किसी अधिशोषक का पृष्ठयो क्षेत्रफल जितना अधिक होता है। अधिशोषण की मात्रा उतनी ही अधिक होती है। अधिशोषण के फलस्वरूप अवशिष्ट पृष्ठीय बल कम हो जाते हैं और इसलिए पृष्ठ ऊर्जा भी कम हो जाती है। इस प्रकार अधिशोषण में सदा ऊर्जा मुक्त होती है। ठोस के पृष्ठ पर किसी गैस के एक ग्राम मोल के अधिशोषित होने पर मुक्त होनेवाली ऊष्मा को मोलर अधिशोषण ऊष्मा कहते हैं।
अधिशोषण निम्नलिखित कारकों पर निर्भर करता है-
(i) अधिशोषक एवं अधिशोषित की प्रकृति : अधिशोषित गैस की मात्रा अधिशोषक और गैस की प्रकृति पर निर्भर करती है। आसानी से संघनित होनेवाली गैसों (NH3, CO2, SO2, HCl आदि) का अधिशोषण स्थायी गैसों (N2, H2, O2, आदि) की तुलना में अधिक मात्रा में होता है। इसका कारण है कि पहले प्रकार की गैसों के अणु दूसरे प्रकार की गैसों के अणु की तुलना में मजबूत बल द्वारा अधिशोषक की सतह में जुड़ते हैं।
(ii) अधिशोषक के पृष्ठ का क्षेत्रफल : अधिशोषण एक पृष्ठीय घटना है, अतः यह अधिशोषक के पृष्ठ के क्षेत्रफल पर निर्भर करता है। अधिशोषक के पृष्ठ का क्षेत्रफल जितना ही अधिक होता है। अधिशोषण की मात्रा भी उतना ही अधिक होती है। ठोस अधिशोषक के किसी निश्चत द्रव्यमान के लिए.कोलॉइडी कणों का पृष्ठीय क्षेत्रफल बहुत अधिक होने के कारण उनकी अधिशोषण क्षमता भी अधिक होती है।
(iii) तापमान : अधिशोषण प्रायः ऊष्माक्षेपी प्रक्रिया है। अतः ली-शैटेलियन सिद्धान्त के . अनुसार तापमान में वृद्धि के साथ अधिशोषण में कमी होती है। उदाहरणार्थ, 600 मिमी० दाब और 0°C ताप पर एक ग्राम चारकोल 10 ml.-29°C पर 20 ml और -78°C पर 45 ml नाइट्रोजन गैस अधिशोषित करता है।
(iv) दाब अथवा सान्द्रण प्रभाव : किसी ठोस के पृष्ठ पर गैस के अधिशोषण की घटना में गैस के दाब में कमी होती है। अतः ली शैटेलियर सिद्धान्त के अनुसार गैस के दाब में वृद्धि होने पर गैस के अधिशोषण का परिणाम बढ़ जाता है। ठोस अधिशोषण के प्रति इकाई क्षेत्रफल : द्रव्यमान पर गैस के अधिशोषण के परिमणाम का दाब के साथ विचरण व्यक्त करने के लिए फ्रायण्डलिक ने समीकरण दिया है जो निम्न प्रकार है-
\(\frac{x}{m}\) = KP1/2
जहाँ x, p दाब पर m ग्राम ठोस अधिशोषक द्वारा अधिशोषित गैस का परिमाण तथा n और k स्थिरांक हैं। यह समीकरण फ्रायण्डलिक अधिशोषण समतापी वक्र कहलाता है।
भौतिक अधिशोषण और रासायनिक अधिशोषण में अन्तर
भौतिक अधिशोषण:
- यह विशिष्ट (Specific) नहीं होता है।
- इसमें गैस अणु ठोस सतह पर वाण्डेर वाल्स बलों के द्वारा बंधे रहते हैं।
- यह गैस की प्रकृति पर निर्भर करता है। अधिक घुलनशील एवं आसानी से द्रवीभूत होनवाली गैसें शीघ्रता से अधिशोषित होती है।
- अधिशोषण की मात्रा अधिशोषक की अपेक्षा अधिशोषत पर अधिक निर्भर होती है।
- अधिशोषण (adsorbate) का दाब बढ़ाने से अधिशोषण की गति बढ़ जाती है।
- अधिशोषण ऊष्मा 20-40 KJ/mol. के बीच होती है।
- यह कम ताप (अधिशोषित के क्वथनांक से नीचे) पर अधिक संभव है।
- यह बहुस्तरीय होता है।
- यह (उत्क्रमणीय) होता है।
- यह अधिशोषक की सतह के क्षेत्रफल पर निर्भर करता है।
रासायनिक अधिशोषण:
- यह अतिविशिष्ट होता है।
- इसमें गैस अणु एवं ठोस सतह के अणुओं अथवा परमाणुओं में रासायनिक बंध होता है।
- यह भी गैस की प्रकृति के साथ यौगिक करता है। जो गैसें अधिशोषक के साथ यौगिक बनाते हैं ये शीघ्रता से अधिशोषित होते हैं।
- इसमें अधिशोषण के दाब बढ़ाने से अधिशोषण की गति कम हो जाती है।
- अधिशोषित के दाब बढ़ाने से अधिशोषण की गति कम हो जाती है।
- अधिशोषण ऊष्मा 80 KJ/mol. से अधिक होती है।
- यह उच्च तापमान पर भी सम्भव है।
- यह केवल ऊपर के स्तर पर ही होता है।
- यह प्रायः अनुत्क्रमणीय होता है।
- यह भी अधिशोषक की सतह के क्षेत्रफल पर निर्भर करता है।
प्रश्न 7.
(A) What do you understand by elevation of boiling point ?
(किसी घोल के क्वथनांक उन्नयन से आप क्या समझते हैं 🙂
(B) State Raoult’s law of elevation of boiling point. Deduce the relationship between the elevation of boiling point and the molecular weight of the non-volatile solute.
(क्वथनांक उन्नयन सम्बन्धी बाउल्ट के नियम को लिखे। क्वथनांक उन्नयन तथा अवाष्पशील घुल्य के अणुभार में सम्बन्ध स्थापित करें।)
(C) What is meant by “Molal elevation constant”?
(मोलल उन्नयन स्थिरांक से क्या समझते हैं ?)
उत्तर:
(A) क्वधनांक का उन्नयन (Eleration of boiling point)- प्रत्येक द्रव एक निश्चित ताप पर उबलता है। इस निश्चित ताप को द्रव का क्वथनांक कहते हैं। इस ताप पर द्रव का वाष्प-दाब वायुमंडलीय दाब के बराबर होता है। हम जानते हैं कि शुद्ध घोलक का वाष्प दाब, घोल के वाष्प दाब से अधिक होता है। अतः शुद्ध घोलक का क्वथनांक, घोल के क्वथनांक से कम होगा। क्योंकि घोल के वाष्प दाब को वायुमण्डलीय दाब के बराबर करने के लिए अतिरिक्त ताप की आवश्यकता होती है, जिससे घोल के क्वथनांक का मान, घोलक के क्वथनांक से बढ़ जाता है।
अतः घोल के क्वथनांक तथा घोलक के क्वथनांक के अन्तर को क्वथनांक का उन्नयन कहते हैं। इसे D Tb द्वारा सूचित किया जाता है।
यदि शुद्ध घोलक का क्वथनांक To°C एवं घोल का क्वथनांक T°C हो, तो क्वथनांक का उन्नयन ΔTb = (T – T0)°C होगा।
(B) राउल्ट के क्वथनांक के उन्नयन सम्बन्धी अपने प्रायोगिकी आंकड़ों के आधार पर निम्नलिखित दो नियमों का प्रतिपादन किया जिसे राठल्ट का नियम (Raoult’s Law) कहते हैं। इनके अनुसार-
पहला नियम-किसी घोल के क्वथनांक का उन्नयन घुल्य के सान्द्रण का समानुपाती होता है।
अर्थात् ΔTb ∝ Cm;
Tb = KbCm
जहाँ ΔTb = क्वथनांक का उन्नयन Cm = घुल्य का मोललता में सान्द्रण तथा Kb = एक स्थिरांक है जिसे मोलल उन्नयन स्थिरांक (Molal elevation constant) या क्वथनांक स्थिरांक (Boiling point constant) कहते हैं।
दूसरा नियम- “यदि विभिन्न पदार्थों की सम आण्विक मात्राएं एक ही घोलक की एक निश्चित मात्रा में अलग-अलग घोली जाए तो सभी घोलों का क्वथनांक उन्नयन बराबर होता है।”
क्वथनांक उन्नयन तथा अवाष्पशील घुल्य के अणुभार में सम्बन्ध- माना कि W ग्राम घोलक में w ग्राम अवाष्पशील घुल्य, जिसका अणुभार m है, घुला हुआ है। अतः घुल्य के ग्राम अणुओं की संख्या w/m। घोल की शक्ति को अणुता (molality) अर्थात् 1000 ग्राम घोलक में घुल्य के ग्राम अणुओं की संख्या) के प्रकट किया जाता है। इस घोल की शक्ति की गणना अणुओं में अग्रांकित प्रकार की जाती है-
∴ W ग्राम घोलक में घुल्य के (w/m) ग्राम-अणु उपस्थित है,

जहाँ Kb एक स्थिरांक है, जिसे 1000 ग्राम घोलक के लिए मोलल उन्नयन स्थिरांक (Molal elevation constant) कहते हैं।
(C) मोलल उन्नयन स्थिरांक (Molal elevation constant)-
राउल्ट के प्रथम नियम से हम जानते हैं कि-
ΔTb ∝ Cm
या, ΔTb = KbCm
जहाँ ΔTb = क्वथनांक का उन्नयन Cm = घुल्य का मोललता में सान्द्रण तथा Kb = एक स्थिरांक है जिसे मोलल उन्नयन स्थिरांक (Molal elevation constant) कहते हैं।
यदि W ग्राम घोल में w ग्राम अवाष्पशील घुल्य, जिसका अणुभार m है, घुला हुआ हो, तो इस घोल की शक्ति की गणना अणुता (Molality) में निम्न प्रकार की जाती है-
∵ W ग्राम घोलक में घुल्य के (w/m) ग्राम-अणु उपस्थिति हैं,

अर्थात्, जिस घोलक के 1000 ग्राम में घुल्य का एक ग्राम अणु घोलने पर उसके क्वथनांक में जो उन्नयन होता है, वह घोलक का मोलल उन्नयन स्थिरांक कहलाता है।
प्रश्न 8.
(A) What do you mean by “Lowering of vapour pressure” and “relative lowering of vapour pressure”?
(“वाष्प दाब का अवनमन” तथा “वाष्य दाब” के आपेक्षिक अवनमन से क्या समझते हैं?)
(B) Write Raoult’s law of relative lowering of vapour pressure. How is it related to the molecular weights of the solvent and the solute?
(राउल्ट के वाष्प दाब के आपेक्षित अवनमन सम्बन्धी नियम को लिखें। यह घोलक तथा घुल्य के अणुभरों से किस प्रकार सम्बन्धित है?)
उत्तर:
(A) वाष्प दाब का अवनमन (Lowering of vapour pressure)- जब किसी अवाष्पशील (Non-volatile) पदार्थ को किसी घोलक में घुला दिया जाता तो समान ताप एवं दाब पर घोल का वाष्प-दाब शुद्ध घोलक के वाष्प दाब से कम हो जाता है। घोल के वाष्प-दाब में यह कमी घुल्य पदार्थ की मात्रा के समानुपाती होती है। अत: किसी अवाष्पशील घुल्य पदार्थ को किसी शुद्ध घोलक में घुला देने पर घोलक के वाष्प दाब में जो कमी होती है, उसे “वाष्य दाब का अवनमन” कहते हैं।
यदि शुद्ध घोलक का वाष्प दाब P0 तथा घोल का वाष्प दाब Ps हो तो वाष्प का अवनमन = (P0 – Ps).
वाध्य दाब का आपेक्षिक अवनमन (Relative lowering of vapour pressure)- वान बाबो (Von-Babo) ने सन् 1848 ई० में अपने अध्ययन के आधार पर बतलाया कि यद्यपि P0 का मान ताप के साथ बढ़ता है परन्तु (P0 – Ps) तथा P0 का अनुपात किसी दिये हुए तनु घोल के लिए प्रत्येक ताप पर सदैव स्थिर रहता है इस अनुपात को “वाष्प दाब का आपेक्षिक अवनमन” कहते हैं। अर्थात् वाष्प दाब का आपेक्षिक अवनम \(\frac{P_{0}-P_{s}}{P_{0}}\) (स्थिरांक)
अतः वाष्प दाब के आपेक्षित अवनमन को निम्न प्रकार परिभाषित किया जा सकता है”वाष्प दाब के अवनमन तथा शुद्ध घोलक के वाष्प दाब के अनुपात को वाष्प दाब का आपेक्षिक अवनमन कहते हैं।”
(B) गाउल्ट का नियम (Rault’s law)- सन् 1887 ई० में राउल्ट ने तनु घोलों के अध्ययन के फलस्वरूप एक नियम प्रतिपादन किया, जिसे “राउल्ट का नियम” कहते हैं। इस नियम के अनुसार-“किसी घोल के वाष्प दाब का आपेक्षिक अवनमन घोल में उपस्थित घुल्य के अणुओं की संख्या तथा पूर्ण अणुओं की संख्या के अनुपात के बराबर होता है।”
इसे निम्न प्रकार भी प्रकट किया जा सकता है-
“किसी घोल के वाष्प-दाब का आपेक्षिक अवनमन घोल में उपस्थित घुल्य के अणु भिन्नांक के बराबर होता है।”
अतः राउल्ट के नियमानुसार
\(\frac{P_{0}-P_{s}}{P_{0}}=\left(\frac{n}{n+N}\right)\)
जहाँ P0 = घोलक का वाष्प दाब, Ps = घोल का वाष्प दाब, n = घोल में उपस्थित घुल्य के ग्राम अणुओं की संख्या तथा N = घोल में उपस्थित घोलक के ग्राम अणुओं की संख्या है।
वाष्प दाब का आपेक्षिक अवनमन तथा घुल्य या घोलकों के अणुभार में संबंध-राउल्ट के नियम से हम जानते हैं कि
\(\frac{P_{0}-P_{s}}{P_{0}}=\left(\frac{n}{n+N}\right)\) …………. (1)
यदि घोल काफी तनु हो, तो n का मान N की तुलना में बहुत कम (लगभग नगणय) होगा। ऐसी स्थिति में उपरोक्त समीकरण (1) को निम्न प्रकार लिखा जा सकता है-
\(\frac{P_{0}-P_{s}}{P_{0}}=\frac{n}{N}\) ………. (2)
यदि किसी प्रयोग में घुल्य एवं घोलक की मात्रा क्रमशः w एवं W ग्राम हो तथा इनके अणुभार क्रमशः m तथा M हो, तो
n = \(\frac{\boldsymbol{w}}{\boldsymbol{W}}\) तथा N = \(\frac{\boldsymbol{w}}{\boldsymbol{M}}\)
अब n तथा N के इन मानों को समीकरण (2) में रखने पर,

समी० (3) वाष्प दाब के आपेक्षिक अवनमन तथा घुल्य या घोलक के अणुभारों में संबंध बतलाया है।
प्रश्न 9.
कार्बोहाइड्रेट के कुख्य कार्यों का उल्लेख करें।
उत्तर:
(i) कार्बोहाइड्रेट Plant cell wall का मुख्य अवयव है। जैसे सेलुलोण plant cell wall का मुख्य घटक है।
(ii) कार्बोहाइड्रेट जैविक इंधन का कार्य करता है। यह जीवित organism की देता है जिससे वह विभन्न कार्य करता है, ग्लुकोज, कटोज, सुगर, स्टार्च, ग्लाइकोजेन इत्यादि जैविक ईंधन का कार्य करता है। अतः ये जीवित organism को ऊर्जा प्रदान करते हैं। जब हम कार्बोहाइड्रेट (सेलुलोज को छोड़कर) खाते हैं तो वह विभिन्न इन्जाइमों द्वारा ग्लुकोज में बदलाव है। ग्लुकोज के ऑक्सीकरण के ऊर्जा की एक बड़ी मात्रा उत्पन्न होती है जिसका उपयोग शरीर विभिन्न कार्यों को करने में करता है।
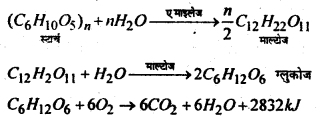
प्रश्न 10.
किसी विलयन के सान्द्रण से आप क्या समझते हैं? किसी विलयन का सान्द्रण कितने प्रकार से व्यक्त किया जा सकता है?
उत्तर:
विलयन का सान्द्रण- किसी वियलन के सान्द्रण का अर्थ है कि विलयन या विलायक की एक निश्तिच मात्रा या आयतन में कितना विलेय घुली हुई है। उदाहरण है, 100 ग्राम घोल में 5 ग्राम घुला हुआ है तो उस घोल का सान्द्रण 5 प्रतिशत है-
किसी विलियन का सान्द्रण निम्न प्रकार से व्यक्त किया जा सकता है-
1. प्रतिशन में- किसी विलय के सान्द्रण को प्रतिशत में तीन प्रकार से व्यक्त किया जा सकता है-
(a) भार-भार के रूप में – इसमें विलेय एवं विलायक दोनों को भार के रूप में व्यक्त किया जाता है। उदाहरणार्थ, यदि किसी विलयन के 100 ग्राम में 15 ग्राम विलेय घुला है तो उस विलयन की सान्द्रता या शक्ति 15 कहलायेगी।
(b) भार-आयतन के रूप में- यदि लियन के ज्ञात आयतन में लिये की एक निश्चित मात्रा घुली हुई होती है तो उस वियलन की सान्द्रता को भार आयतन के रूप में व्यक्त किया जाता है। उदाहरणार्थ, जब विलयन के 100 ml में विलेय का 15 ग्राम घुला हुआ है तो उस घोल की शक्ति 15% (भार/आयतन) कहलाती है।
(c) आयतन-आयतन के रूप में – जब विलयन के ज्ञात आयतन में विलेय का ज्ञात आयतन घुला होता है तो उस विलयन की सान्द्रण को आयतन-आयतन के रूप में व्यक्त किया जाता है उदाहरणर्थ, यदि किसी विलयन के 25ml में विलेय का 5ml घुला है तो उस घोल की सान्द्रता 20% (आयतन/आयतन) होगी।
2. सामान्यता में- जब विलयन के एक लीटर में विलय का जितना ग्राम समतुल्यांक घुल होता है वही उस घोल का सामान्यता कहलाती है। उदाहरणार्थ, यदि विलयन के एक लीटर में विलेय का x ग्राम-समतुल्यांक घुला होता है तो उस विलयन की सान्द्रता सामान्यता में xN कहलाती है।
3. ग्राम प्रति लीटर में- इसमें विलयन का आयतन लीटर में तथा विलेय की मात्रा ग्राम में व्यक्त रहती है। उदाहरणार्थ, यदि कि विलयन के एक लीटर में विलेय का 75 ग्राम घुला होता है तो उस घोल की सान्द्रता 75 ग्राम प्रति लीटर कहलाती है।
4. मोललता में- इसमें विलायक किलो ग्राम में तथा विलेय मोल में व्यक्त रहता है। विलायक के एक किलोग्राम में विलेय का जितना मोल घुला होता है वही उस घोल की मोललता कहलाती है। उदाहरणार्थ, यदि विलायक के 1000 ग्राम में विलेय का 3 मोल घुला है तो मोललता में उस विलयन की सान्द्रता 3 m होगी।
5. मोलरता में- एक लीटर में विलयन में विलेय के जितने मोल घुले होते हैं उस विलयन का मोलरता कहते हैं। जैसे-विलयन के एक लीटर में यदि विलेय के xM होगी।
6. मोल प्रमाज में- विलयन में उपस्थित विलायक या विलेय के ग्राम अणुओं की संख्या और विलयन में उपस्थित कुल मोलों की संख्या का अनुपात मोल प्रभाज कहलाता है। यदि किसी विलयन में विलेय एवं विलायक के ग्राम-अणुओं की संख्या क्रमशः n और N हो तो
विलेय का मोल प्रभाज = \(\frac{n}{n+N}\)और विलायक का मोल प्रभाज = \(\frac{N}{n+N}\) होगा।
7. प्रति मिलियन अंश (Part per million ppm) में – किसी विलयन के दस लाख भाग में विलेय का जितना भाग घुला रहता है, वह ppm में उस विलयन की सान्द्रता होती है। उदाहरणार्थ, ppm में यदि किसी विलयन की सान्द्रता 1 ppm है तो इसका अर्थ है कि विलयन के 106 ग्राम में विलेय का एक ग्राम घुला हुआ है।